Dextrose -Kartoffel, Zubereitung und Verwendung
- 2378
- 581
- Jasmine Kupprion
Er Dextrose -Kartoffelagar Es ist ein solides, nicht -selektives Nährstoffkulturmedium. Darin können Bakterien- und Pilzarten wachsen, aber ihre Verwendung ist insbesondere für die Isolierung von Filamentpilzen und Hefen angezeigt. Es ist auch als PDA -Medium durch den Ausdruck in englischer Kartoffel -Dextrose -Agar bekannt.
Es ist besonders nützlich für die Isolierung von phytopathogenen Pilzen, dh solche, die Gemüse betreffen. Um die Proben aus infiziertem Gemüse zu säen, können andere Medien wie Sabouraud oder Maltagar verwendet werden.
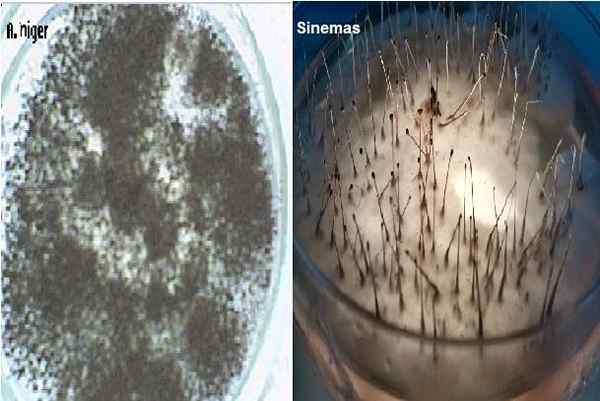
 Aspergillus Niger und Sinemen in Dextrose -Papstagar -Agar. Quelle: Alextrevelian 006 bei English Wikipedia [Public Domain]/Joselrojas [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Aspergillus Niger und Sinemen in Dextrose -Papstagar -Agar. Quelle: Alextrevelian 006 bei English Wikipedia [Public Domain]/Joselrojas [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Es wird auch für die Zählung von Pilzkolonien in Proben von Kosmetika, pharmazeutischen Produkten und einigen Milchprodukten verwendet. Es ist auch förderlich, Hautkratzenproben auf der Suche nach Dermatophyten zu säen, die in diesem Medium sehr gut wachsen und ihre charakteristischen Pigmente entwickeln.
Der mittlere Dextrose -Papst ist ein sehr einfaches und einfaches Medium, um sich im Labor vorzubereiten. Es enthält, wie der Name schon sagt, Kartoffelinfusion, Dextrose und Agar -Agar. Darüber hinaus können inhibitorische Substanzen hinzugefügt werden, um Bakterienwachstum zu vermeiden und die Selektivität für Pilzspezies zu erhöhen.
[TOC]
Basis
Der Dextrose -Papstagar ist ein Kulturmedium, das die notwendigen Ernährungselemente für die Entwicklung von Filamentpilzen und Hefen liefert.
Die Kombination von Kartoffelinfusion mit Glukose bietet die perfekte Energiequelle, damit ein zufriedenstellendes Wachstum von Pilzen besteht. Während Agar derjenige ist, der die Umwelt konsistent macht.
Das Medium allein hemmt das Wachstum von Bakterien nicht, daher ist es ein nicht -selektives Medium. Um dies zu tun, benötigt selektiv das Aggregat von inhibitorischen Substanzen wie Tartarsäure oder Antibiotika.
Vorbereitung
-Hausgemachtes (nichtkommerzielles) Papa Dextrose -Agar -Agar
Petrischplatten
Es ist wie folgt vorbereitet:
Erstens werden die Kartoffeln sehr gut gewaschen, indem sie das Land entfernen, das sie besitzen. Sie werden mit allem und Muschel in feine Scheiben geschnitten. 200 g Kartoffeln werden gewogen und in einem Liter destilliertes Wasser eine halbe Stunde lang kochen.
Die Zeit ist beendet Filter oder die gesamte Vorbereitung durch Gaze.
Die erhaltene Flüssigkeit wird mit destilliertem Wasser abgeschlossen, bis ein Liter erreicht ist. Die Infusion wird 20 g Agar -Agar und 20 g Dextrose zugesetzt, mischt sich gut und Autoklave bei 121 ° C, 15 Pfund Druck 15 Minuten.
Kann Ihnen dienen: KoevolutionLassen Sie bis zu 50 ° C abkühlen und in Petrisch -Sterilplatten servieren. Die vorbereiteten Teller werden im Kühlschrank gehalten.
Keile
Sie können auch Dextrose -Kartoffelkeile vorbereiten.
In diesem Fall vor der Sterilisierung im Autoklaven. In einem Kühlschrank sparen.
Das Medium befindet sich bei einem pH von 5.6 ± 0.2, einige Laboratorien fügen jedoch 10% Tartarsäure hinzu, um den pH -Wert auf 3,1 ± 0 zu senken.1 mit dem Zweck der Hemmung des Bakterienwachstums.
In diesem Sinne ziehen andere Labors lieber Antibiotika hinzu, um dies für die Kultivierung von Pilzen zu tun und die Bakterienentwicklung zu vermeiden.
-Kommerzielle Vorbereitung des Dextrose -Papstagars
Wiegen Sie 39 g im Handel erhältlich dehydriert und löst sich in einem Liter destilliertem Wasser auf. 5 Minuten lassen.
Die Mischung wird durch häufiges Rühren bis zu ihrer Gesamtauflösung erhitzt. Anschließend wird es 15 Minuten in Autoklav bei 121 ° C sterilisiert.
Sie können Teller oder Keile vorbereiten. Fahren Sie wie oben beschrieben fort.
Der pH -Wert beträgt 5,6 ± 0,2. Wenn der pH -Wert von 3,1 gewünscht ist, sollten 14 ml sterarische Tartarsäure zu 20% zugesetzt werden, bevor Sie in den Platten dienen.
Die Farbe des unvorbereiteten Mediums ist beige und hergestellt.
Anwendungen
Prozess zum Pflanzen von Pflanzenproben im Dextrose -Topf
-Für Blätter mit Flecken
Die Blätter werden in Stücke geschnitten.
Legen Sie in einem 50 -cm³ -Gefäß mit 50% Alkohol die Blätterstücke (gefärbte und gesunde Stücke), um die Oberfläche um 20 bis 30 Sekunden zu desinfizieren. Wirf Alkohol und füge Natriumhypochlorit für 40 bis 50 Sekunden lang 20% hinzu, wenn es sich um feine Blätter handelt, und erhöhen.
Werfen Sie das Natriumhypochlorit und nehmen Sie die desinfizierten Stücke mit einer sterilen Klemme und legen Sie sie auf die mittlere Oberfläche (maximal 10 Stücke). Platzieren Sie das Datum und inkubieren Sie von 20 bis 30 ° C.
-Für Früchte und Knollen
Wenn die Frucht fleischig ist, öffnen Sie die vom Pilz betroffene Frucht und nehmen Sie Stücke mit einem sterilen Skalpell, sowohl der Kranken als auch des gesunden Teils und legen Sie sie auf die Oberfläche des Agars.
Wenn die Frucht Zitrusfrüchte wie eine Zitrone oder eine Orange sind, müssen ihre Samen geöffnet und säen werden.
Kann Ihnen dienen: Phosphatidylinositol: Struktur, Training, FunktionenWenn die Fruchtoberfläche betroffen ist und Spenden beobachtet werden, besteht das Ideal darin, die geriebene Methode auf der Platte zu verwenden. Dies besteht darin, das Sporium mit einem sterilisierten und abgekühlten „L“ -Falzspatel zu spielen und dann 2 bis 3 Mal in Zickzack auf dem Agar zu säen.
-Für Körner
Sie desinfizieren dasselbe wie in den Blättern beschrieben und anschließend auf den Agar platziert.
-Für Zweige und Stiele
Ein Raspecue des Kortex wird durchgeführt und dann werden Teile des gesunden und kranken Teils direkt auf dem Agar genommen und gesät.
Die gepflanzten Plaques werden 72 Stunden bei 20-30 ° C in der Aerobiose inkubiert.
Prozess zum Pflanzen von Hautschuppen, Haaren oder Nägeln auf dem Dextrose -Papstagar
Die Probe sollte unter Verwendung eines Skalpellblechs Nr. 11 durchgeführt werden, um betroffene Haare, Haut- oder Nagelschuppen auf der Suche nach Dermatophyten zu schneiden. Vor der Einnahme der Probe muss der Bereich mit 70% Alkohol desinfiziert werden.
-Hautprobe
In den Betrügerläsionen muss der Rand der Verletzung abgekratzt werden, denn dort ist es wahrscheinlicher, dass der Pilz findet.
In exsudativen Läsionen wird die Probe mit trockenem oder nassem Tupfer entnommen. Unmittelbar über den Agar von Papst Dextrose oder Sabouraud säen. Vermeiden Sie Transportmittel.
Eine weitere Probe -Methode besteht durch die Technik von Mariat und Ada Campos 'Teppichplatz. In diesem Fall wird der betroffene Bereich 5 -mal mit einem Stück steriler Wolle für seine nachfolgende Ernte gerieben.
Die Probe kann direkt in das Kulturmedium platziert werden.
-Haarprobe
Abhängig von der Pathologie können der betroffene Teil oder die betroffene Wurzel geschnitten werden. Legen Sie die Probe in das Kulturmedium.
-Probe von Nagel
Sie können abgekratzt oder einen bestimmten Teil des betroffenen Nagels geschnitten werden. Wird von der Art der Verletzung abhängen.
Schneiden Sie die Probe vor der Aussaat in Bits von 1 mm, um die Wahrscheinlichkeit eines Pilzkontakts mit dem Kulturmedium zu erhöhen.
Identifikationsverfahren
Die in der Platte erhaltenen Kolonien sind in Röhrchen isoliert.
Die mikroskopie.
Kann Ihnen dienen: Histidin: Eigenschaften, Struktur, Funktionen, LebensmittelKolonien zählen
Dieses Medium kann auch verwendet werden, um die Ladung von Pilzen und Hefen zu bestimmen, die in Pflanzenproben, Nahrung, Kosmetika oder Drogen vorhanden sind. Zu diesem Zweck wird Kartoffelkartoffel -Agar mit Antibiotika verwendet, wie z.
Gießen Sie 1 ml der Probe - vorzugsweise verdünnt - auf einer sterilen und leeren Petrischplatte, dann eine Dextrose -Kartoffelpistole schmelzen und bei 45 ° C abkühlen lassen. Über die Petrischplatte gießen und bis zur Homogenisierung drehen. In Ruhe lassen.
In der Aerobiose bei 20-25 ° C (Formen) oder bei 30-32 ° C (Hefen) 5 bis 7 Tage oder mehr inkubieren. Zwei Platten können verwendet werden, um beide Temperaturbereiche zu inkubieren.
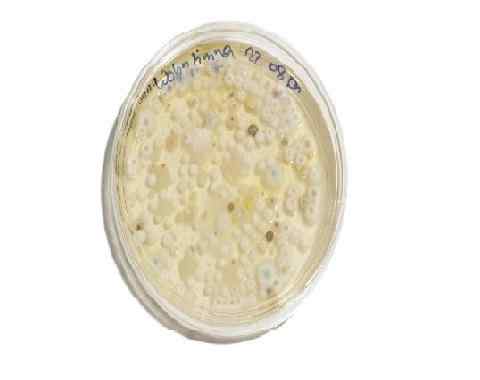 Professor für Pilzkolonien in einer Stichprobe von Lebensmitteln. Dextrose -Kartoffelagar, ergänzt mit Antibiotika. Quelle: pxhere.com Foto/777267
Professor für Pilzkolonien in einer Stichprobe von Lebensmitteln. Dextrose -Kartoffelagar, ergänzt mit Antibiotika. Quelle: pxhere.com Foto/777267 Wartung von Pilzenstämmen
Dextrose Pope Agar kann verwendet werden, um lebensfähige Pilzstämme für mehrere Jahre aufrechtzuerhalten.
Dafür wird der Pilz in Dextrose -Kartoffelkeilen kultiviert und sobald der Pilz wächst, ist er mit Mineralöl bedeckt. Das Öl muss 45 Minuten in Autoklave sterilisiert werden und eine ungefähre Viskosität von 300 bis 330 Saybolt aufweisen. Das Öl muss 1 bis 2 cm die Spitze der Lünette überschreiten.
QA
Von jedem vorbereiteten Grundstück müssen 1 oder 2 Platten für 48 Stunden oder 20 ° C für 96 Stunden bei 25 ° C inkubiert und inkubiert werden. Eine gute Sterilitätskontrolle ist eine, in der die Entwicklung von Kolonien nicht beobachtet wird.
Sie können auch bekannte oder zertifizierte Kontrollen verwenden, wie z. B.:
Saccharomyces cerevisiae ATCC 9763, Candida albicans ATCC 10231, Aspergillus brasiliensis ATCC 16404, Trichophyton Mentagrophyten ATCC 9533. In allen Fällen wird ein gutes Wachstum erwartet.
Verweise
- Britania Laboratories. Glycosado Pot. 2015. Erhältlich bei: Britanialab.com
- Neogen Laboratorien. Dextrose -Kartoffel. Erhältlich bei: Foodsafety.Neogen.com
- Insumolab -Labor. Dextrose -Kartoffelagar. Erhältlich bei: Insumolab.Cl
- Forbes B, Sahm D, Weissfeld A. (2009). Mikrobiologische Diagnose von Bailey & Scott. 12 ed. Pan -American Editorial s.ZU. Argentinien.
- Haushaus g. Allgemeine Mykologie. 1994. 2. Aufl. Zentrale Universität von Venezuela, Bibliotheksausgaben. Venezuela Caracas.
- Aceituno m. Bewertung der mikrobiologischen Qualität in Lidschatten, kompakter Staubtyp eines nationalen Produktionslabors, laut Pharmacoea USP 2005. These für den Titel des pharmazeutischen Chemikers. Universität von San Carlos von Guatemala.
- Cuétara m. Verarbeitung von Oberflächenproben. Ibero -American Mycology Magazine. 2007; pp. 1-12

