Kalziumbicarbonat

- 896
- 64
- Luca Holdt
 Calciumbicarbonat ist ein anorganisches Salz der Bicarbonatgruppe
Calciumbicarbonat ist ein anorganisches Salz der Bicarbonatgruppe Was ist Calciumbicarbonat?
Er Kalziumbicarbonat Es ist ein anorganisches Salz mit chemischer CA -Formel (HCO3)2. Es stammt aus der Natur aus Calciumcarbonat, die in Kalkstein- und Mineralsteinen wie Calcit vorhanden sind.
Calciumbicarbonat ist in Wasser löslicher als Calciumcarbonat. Diese Funktion hat die Bildung von Karstsystemen in Kalksteingesteinen und in der Strukturierung der Höhlen ermöglicht.
Das Grundwasser, das die Risse überquert2).
Diese Gewässer erodieren Kalksteingesteine, die Calciumcarbonat freisetzen (Caco3) dass sich Calciumbicarbonat gemäß der folgenden Reaktion bilden wird:
Dieb3(s) +co2(g) +h2Oder (l) => ca (hco3)2(aq)
Diese Reaktion tritt in den Höhlen auf, in denen sehr harte Gewässer stammen. Calciumbicarbonat befindet sich nicht im Festzustand, sondern in einer wässrigen Lösung zusammen mit der CA2+, Bicarbonat (HCO3-) und das Carbonation (co32-).
Anschließend tritt durch Verringerung der Kohlendioxidsättigung im Wasser die umgekehrte Reaktion auf, dh die Umwandlung von Calciumbicarbonat in Calciumcarbonat:
CA (HCO3)2(aq) => co2 (g) +h2Oder (l) +caco3 (S)
Calciumcarbonat ist im Wasser wenig löslich, was dazu führt, dass der Niederschlag als Feststoff auftritt. Die vorherige Reaktion ist sehr wichtig bei der Bildung von Stalaktiten, Stalagmiten und anderer Dicke in den Höhlen.
Diese felsigen Strukturen werden aus den Wassertropfen gebildet, die von der Decke der Höhlen fallen. Der Kako3 in den Wassertropfen vorhanden wird kristallisiert, um die oben genannten Strukturen zu bilden.
Die Tatsache, Calciumbicarbonat im Festkörper nicht zu finden, hat seine Verwendung behindert und in dieser Hinsicht nur wenige Beispiele gefunden.
Struktur von Calciumbicarbonat
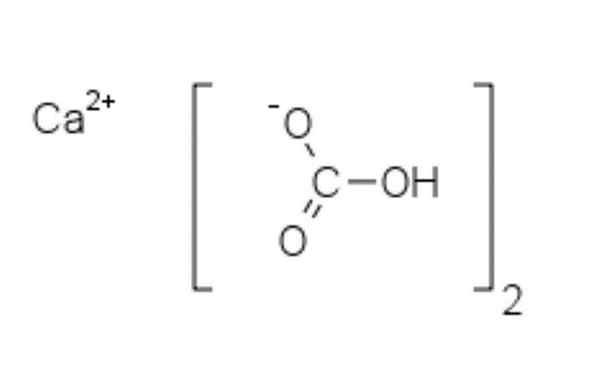 Chemische Struktur von Calciumbicarbonat
Chemische Struktur von Calciumbicarbonat Im oberen Bild werden zwei HCO -Anionen gezeigt3- und ein Cation2+ elektrostatisch interagieren. Die ca2+, Nach dem Bild sollte es sich in der Mitte befinden, da so HCO3- Sie würden sich nicht wegen ihrer negativen Gebühren miteinander ausziehen.
Die negative Last im HCO3- Es verlagert sich zwischen zwei Sauerstoffatomen durch Resonanz zwischen der Carbonyl-C = O-Gruppe und der C-O-Verbindung-; während in co32-, Dies wird zwischen den drei Sauerstoffatomen verlegt, da die C-O-Bindung ungeschützt ist und eine negative Resonanzbelastung erhalten kann.
Es kann Ihnen dienen: DiphenylaminDie Geometrien dieser Ionen können als Kalziumkugeln angesehen werden, die von flachen Carbonatdreiecken mit einem hydrierten Ende umgeben sind. In Bezug auf das Größenverhältnis ist Kalzium bemerkenswert kleiner als HCO -Ionen3-.
Wässrige Lösungen
Kalziumbicarbonat Sie können kristalline Feststoffe nicht bilden, und es besteht wirklich aus wässrigen Lösungen dieses Salzes. In ihnen sind die Ionen nicht allein, wie im Bild, sondern von H -Molekülen umgeben2ENTWEDER.
Jedes Ion ist von einer Hydratationskugel umgeben, die von Metall, Polarität und Struktur der gelösten Spezies abhängt.
Die ca2+ Es koordiniert mit den Sauerstoffatomen des Wassers, um einen Aquokomplex, CA (OH) zu bilden2)N2+, wo n normalerweise als sechs angesehen wird; das heißt, ein "wässriges Oktaeder" um Kalzium.
Während HCO -Anionen3- Sie interagieren gut, entweder mit Wasserstoffbrücken (oder2Co-H-oh2) oder mit den Wasserstoffatomen des Wassers in Richtung der negativen Belastung (hoco2- H-OH, Dipol-Wechselwirkung).
Diese Wechselwirkungen zwischen der CA2+, HCO3- Und Wasser ist so effizient, dass sie Calciumbicarbonat in diesem Lösungsmittel sehr löslich machen; Im Gegensatz zu Calciumcarbonat (Caco3), in denen die elektrostatischen Attraktionen zwischen der CA2+ und die co32- Sie sind sehr stark und auslösen die wässrige Lösung.
Zusätzlich zu Wasser gibt es CO -Moleküle2 rund, die langsam reagieren, um mehr HCO beizutragen3- (Abhängig von pH -Werten).
Hypothetischer Feststoff
Bisher erklären Ionengrößen und Lasten in Calciumbicarbonat oder das Vorhandensein von Wasser, warum es keine feste Verbindung gibt; Das heißt, reine Kristalle, die durch X -Ray -Kristallographie charakterisiert werden können. Calciumbicarbonat ist nichts anderes als im Wasser vorhandene Ionen, aus denen die höhlenartigen Formationen weiter wachsen.
Ja ca2+ und der HCO3- Sie konnten sich vom Wasser isolieren, um die folgende chemische Reaktion zu vermeiden:
CA (HCO3)2(aq) → Caco3(s) + co2(g) + h2Oder (l)
Dann konnten diese in einen weißen kristallinen Feststoff mit stöchiometrischen Proportionen 2: 1 (2HCO) unterteilt werden3/1ca).
Können Ihnen dienen: 30 Beispiele für chemische SuspensionenEs gibt keine Studien über seine Struktur, aber sie könnte mit dem von Natriumbicarbonat verglichen werden (als Magnesiumbicarbonat, MG (HCO)3)2, Es existiert auch nicht als fest) oder mit dem von Calciumcarbonat.
Stabilität: Natriumbicarbonat (Nahco3) vs. Calciumbicarbonat (CA (HCO)3)2)
Natriumbicarbonat kristallisiert im monoklinischen System und Calciumbicarbonat in trigonalen (Calcit) und ortorrombischen Systemen (Aragonit).
Wenn die NA ersetzt werden+ für die ca2+, Das kristalline Netzwerk würde durch den größeren Unterschied in den Größen destabilisiert; Das heißt, die NA+ Um kleiner zu sein, bildet es ein stabileres Glas mit dem HCO3- Im Vergleich zum CA2+.
In der Tat die CA (HCO3)2(aq) braucht Wasser, um zu verdampfen, damit seine Ionen in ein Glas gruppiert werden können. Aber das kristalline Netzwerk davon ist nicht stark genug, um es bei Raumtemperatur zu tun. Beim Erhitzen des Wassers tritt die Zersetzungsreaktion auf (Gleichung von oben).
Das Ion na sein+ In Lösung würde dies das Glas mit dem HCO bilden3- vor seiner thermischen Zersetzung.
Der Grund, warum Calciumbicarbonat (theoretisch) nicht (theoretisch) kristallisiert, ist der Unterschied von ionischen Funkgeräten oder Größen ihrer Ionen, die vor ihrer Zersetzung keinen stabilen Kristall bilden können.
Calciumbicarbonat (CA (HCO)3)2) vs. Calciumcarbonat (Caco3)
Wenn andererseits H hinzugefügt wird+ Zu den kristallinen Strukturen von Calciumcarbonat würden sie ihre physikalischen Eigenschaften drastisch verändern. Vielleicht fallen ihre Schmelzpunkte erheblich und sogar die Morphologien der Kristalle enden modifiziert.
Physikalische und chemische Eigenschaften
Chemische Formel
CA (HCO3)2
Molekulargewicht
162.11 g/mol
Körperlicher Status
Es erscheint nicht im Feststaat. Es kommt in wässriger Lösung und beim Verdampfen von Wärme wird es Calciumcarbonat.
Wasserlöslichkeit
16,1 g/100 ml bei 0º C; 16,6 g/100 ml bei 20 ° C und 18,4 g/100 ml bei 100 ° C.
Diese Werte weist auf eine große Affinität der Wassermoleküle durch die Ionen des Calciumbicarbonat hin, wie im vorherigen Abschnitt erläutert. In der Zwischenzeit lösen sich nur 15 mg Calciumcarbonat in einem Liter Wasser auf, was seine starken elektrostatischen Wechselwirkungen widerspiegelt.
Weil Calciumbicarbonat kann nicht fest bilden, seine Löslichkeit kann nicht experimentell bestimmt werden.
Angesichts der vom CO erzeugten Bedingungen jedoch2 In dem Wasser gelöst, das den Kalkstein umgibt, konnte die bei einer t -Temperatur gelöste Masse des Kalziums berechnet werden. Masse, die der Konzentration von Calciumbicarbonat entspricht.
Kann Ihnen dienen: Bennyinsäure: Synthese, Transposition und verwendetBei unterschiedlichen Temperaturen nimmt die gelöste Masse zu, wie in den Werten bei 0, 20 und 100 ° C gezeigt. Dann wird nach diesen Experimenten bestimmt, wie viel von Calciumbicarbonat Es löst sich in der Nähe von Calciumcarbonat in einem wässrigen Medium, das mit CO vergapft wurde2.
Sobald der CO entkommt2 Calciumcarbonat fällt aus, jedoch nicht Calciumbicarbonat.
Fusion und Siedepunkte
Das Kristallnetzwerk der CA (HCO3)2 Es ist viel schwächer als das des Kakos3. Wenn es in einem Feststoffzustand erhalten werden könnte und die Temperatur messen, bei der es innerhalb einer Quelle schmilzt, würde sicherlich ein Wert deutlich unter 899 ° C erhalten. Ebenso ist das Gleiche zu erwarten, um den Siedepunkt zu bestimmen.
Verbrennungspunkt
Es ist kein Kraftstoff.
Risiken
Da diese Verbindung nicht fest existiert, ist es unwahrscheinlich, dass sie ein Risiko darstellt, seine wässrigen Lösungen zu manipulieren, da beide Ionen CA2+ Wie hco3- Sie sind für niedrige Konzentrationen nicht schädlich; Und daher könnte das größte Risiko, die solche Lösungen aufnehmen würden, nur auf eine gefährliche Dosis von Kalzium zurückzuführen sein.
Wenn die Verbindung einen Feststoff bildete, sogar möglicherweise physikalisch anders als der Kako3, Die toxischen Wirkungen konnten nach physikalischem Kontakt oder Einatmen nicht über einfache Beschwerden und Resektionen hinausgehen.
Anwendungen
- Calcium -Bicarbonat -Lösungen wurden lange Zeit verwendet, um alte Papiere, insbesondere Kunstwerke oder historisch wichtige Dokumente zu waschen.
- Bicarbonatlösungen wurden zur Vorbeugung von Osteoporose verwendet. In einem Fall wurden jedoch in einem Fall Nebenwirkungen wie Hyperkalzämie, metabolische Alkalose und Nierenversagen beobachtet.
- Calciumbicarbonat wird gelegentlich intravenös verabreicht, um die depressive Wirkung der Hypokaliämie auf die Herzfunktion zu korrigieren.
- Es wird verwendet, um Magensäure zu beruhigen.
Verweise
- Wikipedia (2018). Kalziumbicarbonat. Genommen von: in: in.Wikipedia.Org
- Sirah Dubois (3. Oktober 2017). Was ist Calciumbicarbonat? Erholt von: Livestrong.com
- Science Learning Hub (2018). Carbonatchemie. Erholt von: Scientelarn.Org.NZ
- Pubchem (2018). Kalziumbicarbonat. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung

