Strukturstruktur der Lustsäure (HNO2), Eigenschaften, Synthese

- 4781
- 936
- Jasmine Kupprion
Er Salpetersäure Es ist eine schwache, anorganische Säure, deren chemische Formel HNO ist2. Es ist grundlegend in wässriger Lösung mit einer hellblauen Färbung. Es ist sehr instabil und wird schnell in Stickoxid, nein und in Salpetersäure, ino3.
Es befindet sich normalerweise in wässriger Lösung in Form von Nitriten. Es kommt natürlich auch aus der Atmosphäre aufgrund der Reaktion von Stickoxid mit Wasser. Dort interveniert insbesondere in der Troposphäre die Liegensäure in der Regulation der Ozonkonzentration.
 Laldus -Säure -Lösung in einem Becher. Quelle: Kein maschinenlesbarer Autor zur Verfügung gestellt. Der verrückte Wissenschaftler ~ Commonswiki nahm an (basierend auf Urheberrechtsansprüchen). [Public Domain]
Laldus -Säure -Lösung in einem Becher. Quelle: Kein maschinenlesbarer Autor zur Verfügung gestellt. Der verrückte Wissenschaftler ~ Commonswiki nahm an (basierend auf Urheberrechtsansprüchen). [Public Domain] Im oberen Bild wird eine HNO -Lösung gezeigt2 Wo die charakteristische hellblaue Farbe dieser Säure zu sehen ist. Es wird durch die Auflösung von Stickstofftrioxid, n2ENTWEDER3, Im Wasser. Ebenso ist es das Produkt der Versauerung von Natriumnitritlösungen bei niedrigen Temperaturen.
Der hno2 Es hat wenig kommerzielle Verwendung in Form von Nitrit bei der Erhaltung von Fleisch. Andererseits wird es bei der Ausarbeitung von azoischen Farbstoffen verwendet.
Es wird zusammen mit Natriumthiosulfat bei der Behandlung von Patienten mit Natriumcyanidvergiftung verwendet. Es ist jedoch ein mutagener Mittel, und es wird angenommen, dass es in den Basen der DNA -Ketten Substitutionen durch eine oxidative Desaminierung des Zytosins und Adenin verursachen kann.
Lindrosäure hat ein doppeltes Verhalten, da sie sich als oxidatives Mittel oder als Reduktionsmittel verhalten kann. Das heißt, es kann auf no oder n reduziert werden2, oxidieren3.
[TOC]
Lessungstruktur
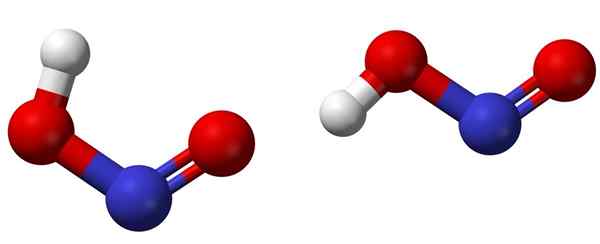 Cis (links) und trans (rechts) Isomere mit den jeweiligen molekularen Strukturen von HNO2. Quelle: Ben Mills [Public Domain].
Cis (links) und trans (rechts) Isomere mit den jeweiligen molekularen Strukturen von HNO2. Quelle: Ben Mills [Public Domain]. Das obere Bild zeigt die molekulare Struktur von Laldsäure mittels eines Kugeln- und Balkenmodells. Das Stickstoffatom (blaue Kugel) befindet sich in der Mitte der Struktur und bildet eine Doppelbindung (n = o) und eine einfache (n-o) mit Sauerstoffatomen (rote Kugeln).
Beachten Sie, dass das Wasserstoffatom (weiße Kugel) mit einem Sauerstoff verbunden ist und nicht direkt mit Stickstoff. Also, die strukturelle Formel des HNO zu wissen,2 Es ist [ho-n = o] oder [nein (oh)], und es gibt keine solche H-N-Verbindung (wie die chemische Formel denken kann).
Die Bildmoleküle entsprechen denen einer Gasphase; Im Wasser sind sie von Wassermolekülen umgeben, die das Wasserstoffion (schwach) akzeptieren können, um die Ionen nicht zu bilden2- und h3ENTWEDER+.
Kann Ihnen dienen: BecherSeine Strukturen können zwei Formen annehmen: cis oder trans, die als geometrische Isomere bezeichnet werden. Im CIS -Isomer ist das H -Atom mit dem benachbarten Sauerstoffatom in den Schatten gestellt; Während im Trans -Isomer befindet sich beide in Anti -Apposite -Positionen.
Im CIS-Isomer ist wahrscheinlich die Bildung eines intramolekularen Wasserstoffs (OH-NO), der intermolekular (Onoh-Onoh) importieren kann.
Eigenschaften
Chemische Namen
-Salpetersäure
-Dioxonitricsäure (III)
-Nitrosile -Hydroxid
-Hydroxideoxidonitrogen (IUPAC -systematischer Name)
Physische Beschreibung
Hellblau Flüssigkeit, entsprechend der Nitritlösung.
Molekulargewicht
47.013 g/mol.
Dissoziationskonstante
Es ist eine schwache Säure. Sein PKA beträgt 3,35 bis 25 ° C.
Schmelzpunkt
Ist nur in Lösung bekannt. Daher kann Ihr Schmelzpunkt nicht berechnet werden, noch können Ihre Kristalle isoliert werden.
Siedepunkt
Durch nicht vorhandenes reines, aber in Wasser sind die Messungen dieser Eigenschaft nicht präzise. Einerseits hängt es von der Konzentration des HNO ab2, Und andererseits produziert seine Erwärmung seine Zerlegung. Deshalb wird kein genauer Siedepunkt gemeldet.
Verkaufsbildung
Lösliches Wasser -lösliche Nitriten mit Li+, N / A+, K+, AC2+, Herr2+, Ba2+. Aber formen Sie keine Salze mit vielseitigen Kationen, wie z3+ und/oder sein2+ (aufgrund seiner hohen Lastdichte). Es ist in der Lage, mit Alkohols stabile Ester zu bilden.
Brandpotential
Es ist entflammbar für chemische Reaktionen. Kann durch Kontakt mit Phosphor -Trichlorid explodieren.
Zersetzung
Es ist eine sehr instabile Verbindung, und in wässriger Lösung zersetzt sie sich in Stickoxid und Salpetersäure:
2 Hno2 => Nein2 + Nein +h2ENTWEDER
4 Hno2 => 2 hno3 + N2Oder +h2ENTWEDER
Reduktionsmittel
Liegensäure in wässriger Lösung wird in Form von Nitritionen dargestellt, nein2-, welche mehrere Reduktionsreaktionen erleben.
Reagiert mit Ionen I- und Glaube2+, in Form von Kaliumnitrit, um Stickoxid zu bilden:
2 Kno2 + Ki +h2SW4 => I2 + 2 nein +2 h2Oder +k2SW2
Kaliumnitrit in Gegenwart von Zinnionen wird reduziert, um Lachgas zu bilden:
Kno2 + 6 HCl +2 SNCL2 => 2 SNCL4 + N2O +3 h2O +2 kcl
Kann Ihnen dienen: Beryl Hydroxid (BE (OH) 2)Kaliumnitrit wird durch Zn in einer alkalischen Umgebung reduziert und bildet Ammoniak:
5 h2O +Kno2 + 3 Zn => NH3 + KOH +3 Zn (OH)2
Oxidationsmittel
Neben dem Reduktionsmittel kann Staffeln Säure in Oxidationsprozesse eingreifen. Zum Beispiel: oxidieren.
2 Hno2 + H2S => s +2 nein +2 h2ENTWEDER
Hno2 + 3 h2S => S +NH3 + 2 h2ENTWEDER
Liegensäure kann in einem sauren pH -Medium Jodidion zu Jod oxidieren.
Hno2 + Yo- + 6 h+ => 3 i2 + NH3 + 2 h2ENTWEDER
Sie können auch als Reduktionsmittel auf CU wirken2+, Salpetersäure verursachen.
Nomenklatur
Zum Hno2 Sie können andere Namen geben, die von der Art der Nomenklatur abhängen. Lessrossäure entspricht der traditionellen Nomenklatur; Dioxonitricsäure (III) zur Aktiennomenklatur; und Dioxonitrat (iii) von Wasserstoff zum systematischen.
Synthese
Liegensäure kann durch Auflösen von Stickstofftrioxid in Wasser synthetisiert werden:
N2ENTWEDER3 + H2O => 2 hno2
Eine andere Herstellungsmethode ist die Reaktion des Natriumnitrits, Nano3, mit Mineralsäuren; wie Salzsäure und Bromhyterinsäure. Die Reaktion erfolgt bei niedriger Temperatur und die Lessungssäure wird in situ verbraucht.
Älterer Bruder3 + H+ => Hno2 + N / A+
Die h+ Es kommt entweder von HCL oder HBR.
Risiken
Angesichts der chemischen Eigenschaften und Merkmale gibt es nur wenige Informationen über die direkten toxischen Wirkungen des HNO2. Möglicherweise werden einige schädliche Wirkungen, die angenommen werden, von dieser Verbindung hergestellt, tatsächlich durch Salpetersäure verursacht, die durch Zersetzung von Stacheln auftreten können.
Es wird darauf hingewiesen, dass der HNO2 Es kann schädliche Auswirkungen auf die Atemwege haben und in der Lage sein, bei asthmatischen Patienten Symptome einer Reizung zu erzeugen.
In Form von Natriumnitrit wird es durch Deoxyhämoglobin reduziert, wodurch Stickoxid produziert wird. Dies ist ein starker Vasodilatator, der die Entspannung der glatten Gefäßmuskeln erzeugt und beim Menschen eine Dosis von 35 mg/kg für den oralen Verbrauch schätzt.
Die Natriumnitritentoxizität manifestiert sich mit einem kardiovaskulären Kollaps, gefolgt von einer schweren Hypotonie aufgrund der aus Nitrit hergestellten Vasodilatatorwirkung von Stickoxid.
Stickstoffdioxid, nein2, In kontaminierter Luft (SMOG) kann sie unter bestimmten Bedingungen Liegensäure verursachen; was wiederum mit Aminen reagieren kann, um Nitrosamin zu bilden, eine Gamma krebserzeugter Verbindungen.
Es kann Ihnen dienen: Silberoxid (AG2O)Eine ähnliche Reaktion tritt mit dem Rauch von Zigaretten auf. Es wurden Nitrosaminreste gefunden, die an der Innenauskleidung von Rauchfahrzeugen festgehalten wurden.
Anwendungen
Diazonium -Verkaufsproduktion
In der Branche wird bei der Herstellung von Diazoniumsalzen durch ihre Reaktion mit aromatischen Aminen und Phenolen Lachsäure eingesetzt.
Hno2 + Rnah2 + H+ => RNA = nar +h2ENTWEDER
Diazoniumsalze werden in organischen Synthesereaktionen verwendet; Zum Beispiel in Sandmeyers Reaktion. In dieser Reaktion erfolgt der Ersatz einer Aminogruppe (h2N-) in einem primären aromatischen Amin von den CL-Gruppen-, Br- und cn-. Um diese aromatischen Produkte zu erhalten, sind Coupro -Salze erforderlich.
Diazoniumsalze können brillante Dachverbindungen bilden, die als Farbstoffe verwendet werden und auch als qualitativer Test dienen, um das Vorhandensein aromatischer Amine zu erkennen.
Natrium Azida Elimination
Lobusäure wird verwendet, um Natriumazid zu beseitigen3), was möglicherweise gefährlich ist, um seine Tendenz zu nutzen.
2 Nan3 + 2 Hno2 => 3 n2 + 2 NEIN +2 NAOH
Synthese von Oximas
Lessroundsäure kann mit Ketongruppen reagieren, um Oximas zu bilden. Diese können oxidiert werden, um Carboxils zu bilden oder Säure zu reduzieren, um Amin zu verursachen.
Dieses Verfahren wird zur kommerziellen Herstellung von Adipinsäure verwendet, einem Monomer, das in der Nylonproduktion verwendet wird. Es interveniert auch in die Produktion von Polyurethan und seine Ester sind Weichmacher, hauptsächlich im PVC.
Unter seiner Salzform
Liegensäure in Form von Natriumnitrit wird bei der Behandlung und Erhaltung von Fleisch verwendet; Da es das Bakterienwachstum verhindert und in der Lage ist, mit Myoglobin zu reagieren, wodurch eine dunkelrote Farbe erzeugt wird, die Fleisch für den Konsum attraktiver macht.
Das gleiche Salz wird zusammen mit Natriumthiosulfat bei der intravenösen Behandlung der Natriumcyanidvergiftung verwendet.
Verweise
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley Plus.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Pubchem. (2019). Salpetersäure. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Softschools. (2019). Salpetersäure. Geborgen von: Softschulen.com
- Wikipedia. (2019). Salpetersäure. Abgerufen von: in.Wikipedia.Org
- Royal Society of Chemistry. (2015). Salpetersäure. Erholt von: Chemspider.com
- New World Encyclopedia. (2015). Salpetersäure. Erholt von: Newworldyclopedia.Org
- Drogenbank. (2019). Salpetersäure. Erholt von: Drugbank.AC
- Chemische Formulierung. (2018). Hno2. Wiederhergestellt von: Quimica -Formulierung.com
- « Zahlen oder Indikatoren, die über Bildungsvorschüsse in einem Land sprechen
- Alkyl -Halogenuros -Eigenschaften, erhalten, Beispiele »

