Citokoma -C -Oxidasestruktur, Funktionen, Inhibitoren
- 4603
- 1493
- Timo Rabenstein
Der Citocroma -C -Oxidase Es ist ein enzymatischer Proteinkomplex, der die Lipiddoppelschicht der Zellmembran überqueren kann. Wir waren hauptsächlich mit der inneren Membran der Mitochondrien in Verbindung gebracht, die sowohl in prokaryotischen Organismen (Bakterien) als auch in Eukaryoten (einzellig und multizellulär) sind (Bakterien).
Dieses Enzym wird auch als Komplex IV bezeichnet und ist für die aeroben Stoffwechselfunktionen der Organismen von entscheidender.
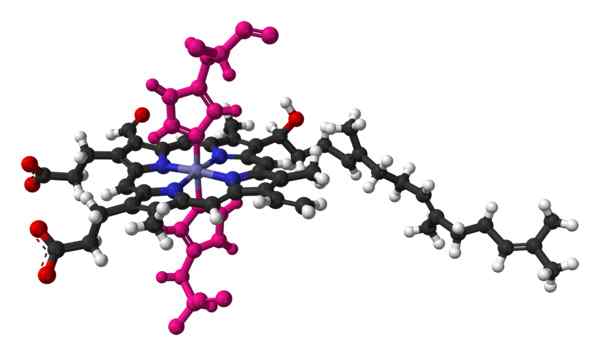
 Bola- und Palo -Modell des Hämos eines Molekül. Genommen und bearbeitet von: Benjah-BMM27 [Public Domain].
Bola- und Palo -Modell des Hämos eines Molekül. Genommen und bearbeitet von: Benjah-BMM27 [Public Domain]. Der Cytochromname bedeutet "Zellpigmente". Dies sind Blutproteine, die Elektronen transportieren. Die Cytochrome wurden 1884 vom irischen Doktor Charles Alexander MacMunn entdeckt. MacMunn war ein Pionier bei der Entdeckung des Atempigments des Blutes, das heute Cytochrom 1 bezeichnet wird.
In den 20ern des letzten Jahrhunderts russischen Entomologen und Parasitologen. Obwohl MacMunn sie 1884 entdeckt hatte, hatte die wissenschaftliche Gemeinschaft vergessen und sogar einige haben ihre Arbeit missverstanden.
[TOC]
Allgemeine Charakteristiken
Im Allgemeinen haben Atempigmente charakteristische sichtbare Spektren. Es ist bekannt, dass es mindestens vier umfassende Membranproteinkomplexe gibt, in denen 5 verschiedene Arten von Cytochromen vorhanden sind: A, A3, B, C1 und C, die nach den Wellenlängen der spektralen Absorptionsmaximums klassifiziert sind.
Sie kommen normalerweise in der inneren Membran von Mitochondrien vor. Sie wurden jedoch auch im endoplasmatischen Retikulum und in Chloroplasten in eukaryotischen und prokaryotischen Organismen beobachtet.
Sie präsentieren die Hämoprothesegruppe mit Eisen (Glaube). Jedes der bekannten Cytochrome wirkt in multienzimatischen Komplexen im Transport von Elektronen der Atemwege.
Cytochrome haben die Funktion, an Oxid-Reduktionsreaktionen teilzunehmen. Reduktionsreaktionen, bei denen sie Elektronen akzeptieren, treten für jede Art von Cytochrom unterschiedlich auf, und ihr Wert wird durch den Fluss von Atemwegselektronen bestimmt.
-Cytochrom c
Vier Arten von Cytochrom C sind bekannt, die folgenden sind.
Klasse I
Innerhalb dieser Klasse befinden sich die Cytochrome C -Lösungen von niedriger Kurve (Tiefspin), die in Bakterien und Mitochondrien vorhanden sind. Sie sind Oktaedralen. Die Hemo -Union -Stelle befindet sich am Ende des Histidins und der sechste Ligand wird am Ende C durch einen Metioninrest versetzt C.
Aus dieser Klasse können Sie sogar mehrere Unterklassen erkennen, die ihre dreidimensionale Struktur bestimmt haben.
Klasse II
In dieser Klasse gibt es Zytokrome C mit hoher Kurve (hoher Spannung) und einige niedrige Kurven. Die Hochverdrehung ist die Bindungsstelle in der Nähe des End-C, und bei denen mit niedriger Kurve scheinen der sechste Ligand ein Metioninrest in der Nähe des N-Termus-Endes in englischer Sprache zu sein. Sie sind pentacoordiniert mit dem fünften Ligandenhistin.
Kann Ihnen dienen: Treffer (Biologie)Klasse III
Diese Klasse ist durch Cytochrome C mit mehreren Hemo (C3 und C7) und einem Niedrigpotential-Oxid-Reduktor mit nur 30 Aminosäureresten pro Hemo gekennzeichnet. In den Vertretern dieser Klasse haben die HEMO -C -Gruppen Struktur- und nicht -äquivalente Funktionen, zusätzlich zur Darstellung verschiedener Redoxpotentiale. Sie sind Oktaedralen.
Klasse IV
Laut einigen Autoren wurde diese Klasse nur so erstellt, dass komplexe Proteine unter anderem von anderen prothetischen Gruppen sowie HEMO C oder Flavocytocrom C enthalten sind.
Die Cytochrom -C -Oxidase oder der Komplex IV
Die Cytochrom -C -Oxidase ist ein mitochondriales Enzym, das die endgültige Phase des elektronischen Transports bei der Zellatmung durchführt. Dieses Enzym katalysiert den Elektronentransport von reduziertem Cytochrom C bis Sauerstoff.
Einige chemische Verbindungen wie Cyanid, Kohlendioxid und Azide. Andere Formen der Hemmung des IV -Komplexes sind genetische Mutationen.
Aus evolutionärer Sicht wird Cytochrom -C -Oxidase nur in aeroben Organismen gefunden, und mehrere Gruppen von Wissenschaftlern legen nahe, dass das Vorhandensein dieses Proteins evolutionäre Beziehungen anzeigt, in denen Pflanzen, Pilze und Tiere auch einen Vorfahren in gemeinsamen Vorfahren teilten.
Struktur
Das Cytochrom -C -Oxidase bildet einen homodimeren Komplex, dh aus zwei ähnlichen Monomeren in der inneren Membran der Mitochondrien. Der enzymatische Komplex besteht aus 3 bis 4 Untereinheiten in prokaryotischen Organismen und bis zu maximal 13 (einige schlagen 14) Polypeptide in Organismen wie Säugetieren.
In diesen Organismen sind 3 Polypeptide mitochondrialer Ursprung und der Rest entsteht im Kern. Jedes Monomer verfügt.
Es hat nur eine katalytische Einheit, die in allen Enzymen vorkommt, die Oxidations-/Reduktionsreaktionen unter Verwendung molekularer Sauerstoff (Oxidasen, insbesondere Hämo-Kobre) katalysieren, katalysiert. Der Komplex enthält Cytochrome A und A3, die durch Untereinheit I und zwei Kupferzentren vereint sind.
Es präsentiert eine oder mehrere HEMO -C. Andere Autoren schlagen vor, dass es eine einzelne HEMO -C -Gruppe gibt, die mit dem Protein zwischen dem Porphyrinring und zwei Cysteinresten verbunden ist.
Die oben erwähnte einzige Hämo -C.
Kann Ihnen dienen: Pflanzenzelle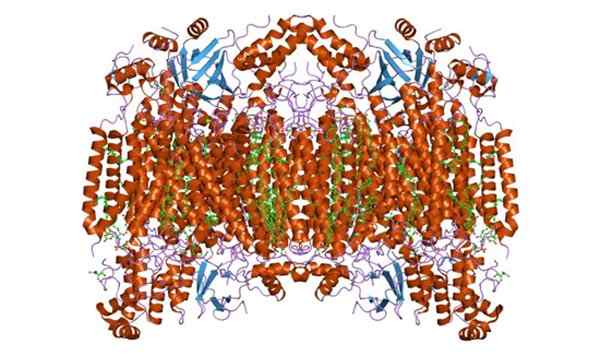 Cytochrom -C -Oxidase -Untereinheit f. Genommen und bearbeitet von: Jawahar Swaminathan und MSD -Mitarbeitern am Europäischen Bioinformatikinstitut [Public Domain]
Cytochrom -C -Oxidase -Untereinheit f. Genommen und bearbeitet von: Jawahar Swaminathan und MSD -Mitarbeitern am Europäischen Bioinformatikinstitut [Public Domain] Funktionen
Citocomom -C -Oxidasen sind Protagonisten in drei primären physiologischen Mechanismen, die wir unten sehen werden.
Apoptose oder programmierter Zelltod
Apoptose ist die Zerstörung oder der programmierte Zelltod, der durch denselben Organismus verursacht wird und der darauf abzielt, das Wachstum, die Entwicklung, die Eliminierung beschädigter Gewebe und die Regulierung des Immunsystems zu kontrollieren. In diesem physiologischen Prozess beteiligt sich die Cytochrom -C -Oxidase als Vermittler.
Dieses von Mitochondrien freigesetzte Protein führt zu einer Wechselwirkung mit dem endoplasmatischen Retikulum, das die Sekretion oder Freisetzung von Kalzium verursacht. Die progressive Zunahme von Calcium löst eine massive Freisetzung von Cytochrom -C -Oxidase aus, bis es möglich ist, die zytotoxischen Calciumspiegel zu erreichen.
Zytotoxische Calciumspiegel und die Freisetzung von Cytochromen C verursachen die Kaskadenaktivierung mehrerer Enzyme, die für die Zerstörung von Zellen verantwortlich sind.
Zell- oder Geweberegeneration
Mehrere Studien zeigen, dass, wenn Cytochrom -C -Oxidase Wellenlängen von 670 Nanometern ausgesetzt ist, an einem funktionellen Komplex teilnimmt, der beschädigtes oder verletztes Gewebe durchdringt und die Geschwindigkeit der Zellregeneration erhöht.
Energiestoffwechsel
Dies ist vielleicht die bekannteste und relevanteste Funktion von Cytochrom C Oxidase. Genau der Oxidasekomplex (der Atemkette), das für das Sammeln der Elektronen des Cytochroms C verantwortlich ist und sie auf das Sauerstoffmolekül überträgt, um es auf zwei Wassermoleküle zu reduzieren.
An diesem Prozess verbunden, gibt es eine Translokation von Protonen durch die Membran, was zur Erzeugung eines elektrochemischen Gradienten führt, den der ATP -Synthesekomplex zur Herstellung oder Synthese von ATP (Adenosín Triffisphyte) verwendet,.
Inhibitoren
Citocomom Coxidase wird durch verschiedene chemische Prozesse und Verbindungen gehemmt. Die Art und Weise, wie es auftritt.
In Gegenwart von Azid. Dies führt zu einer Unterbrechung des zellulären Atemwegsprozesses und verursacht daher die chemische Erstickung von Zellen.
Eine andere Verbindung wie Stickoxid, Wasserstoffsulfid, Methanol und einige methylierte Alkohole verursachen auch Cytochrom -C -Oxidase -Hemmung.
Mangel
Die Cytochrom -C -Oxidase ist ein Enzym, das sowohl von Genen des Kerns als auch der Mitochondrien kontrolliert wird. Es gibt genetische Veränderungen oder Mutationen, die einen Mangel an Cytochrom -C -Oxidase tragen können.
Diese Mutationen stören die Funktionalität des Enzyme.
Kann Ihnen dienen: dendritische Zellen: Eigenschaften, Funktion, TypenCytochrom -C -Oxidase -Mangel wirkt sich auf Gewebe mit hohem Energiebedarf wie Herz, Leber, Gehirn und Muskeln aus. Die Symptome dieser Mutationen spiegeln sich vor den zwei Lebensjahren wider und können sich als starke oder milde Erkrankungen manifestieren.
Milde Symptome sind auch kurz nach dem ersten Lebensjahr zu sehen, und in der Regel haben Personen mit ihnen nur eine Abnahme der Muskelverspannungen (Hypotonie) und der Muskelatrophie (Myopathie).
Auf der anderen Seite können Personen mit stärkeren Symptomen eine Muskelatrophie und eine Enzephalopathie aufweisen. Andere Erkrankungen, die durch das Fehlen von Cytochrom -C -Oxidase verursacht werden.
Verwendung in Phylogenie
Phylogenie ist die Wissenschaft, die für die Studien von Herkunft, Ausbildung und evolutionärer Entwicklung aus der Sicht der Vorfahren verantwortlich ist, von Organismen. In den letzten Jahrzehnten wurden Phylogeniestudien mit molekularer Analyse immer häufiger, um viele Informationen zu werfen und taxonomische Probleme zu lösen.
In diesem Sinne zeigen einige phylogenetische Studien, dass die Verwendung von Cytochrom -C -Oxidasen dazu beitragen kann, evolutionäre Beziehungen aufzubauen. Dies liegt daran.
Beispiel hierfür sind die Tests mit Menschen, Schimpansen (Brot) und Rhesus -Makaken (Mulatta Macaca). Solche Tests zeigten, dass Cytochrom -C -Oxidase -Moleküle von Menschen und Schimpansen identisch waren.
Er zeigte auch, dass die Cytochrom -C -Oxidase -Moleküle der Rhesus -Makaque.
Verweise
- R.P. Ambler (1991). Sequenzvariation in bakteriellen Cycromen C. Biochimica et Biophysica Acta (BBA) - Bioenergetics.
- Cytochrom c. Von Newworldyclopedia geborgen.Org.
- V.Colman, e. Kosten. Chaves, v. Tortora (2015). Biologische Rollen von Cytochrom C: mitochondrialer elektronischer Transport, programmierter Zelltod und Aus -Aktivitätszuwachs. Annalen der Fakultät für Medizin.
- Cytochrom -C -Oxidase -Untereinheit i. Von EBI geborgen.AC.Vereinigtes Königreich.
- L. YouFen, p. Jeong-Oon, d. Jian-Hong & B. Yidong (2007). Cytochrom C Oxidase -Untereinheit IV ist für den Zusammenbau und die Atemfunktion des Enzymkomplexes essentiell. Journal of Bioenergetics und Biomembranen.
- Gengruppe: Komplex IV Mitochondrial: Cytochrom-C-Oxidase-Untereinheiten (COX, MT-CO). Von Genenamen geborgen.Org.
- UND.F. HARTREE (1973). Die Entdeckung von Cytochrom. Biochemische Ausbildung.
- Citocrom Coxidase, Mangel von .. . Von Ivami geborgen.com.
- C.K. Mathews, k.UND. Van Hold & k.G. Ahern (2002). Biochemerie. 3. Auflage. Benjamin / Cummings Publishing Company, Inc.
- « Opotillo -Eigenschaften, Lebensraum, Eigenschaften und Schädlinge
- Pinus Patula -Eigenschaften, Lebensraum, Taxonomie, Verwendungen, Schädlinge »

