Chromchlorid (CRCL3) -Struktur, Eigenschaften, verwendet

- 2499
- 303
- Rieke Scheer
Er Chromchlorid (CRCL3) Es ist ein anorganisches Salz, das aus Cr -Kationen besteht3+ und Clanionen- in einem 1: 3 -Verhältnis; Das heißt für jeden CR3+ Es gibt drei cl-. Wie später zu sehen wird, sind ihre Wechselwirkungen nicht ionisch. Dieses Salz kann in zwei Formen auftreten: Anhydra und Hexahydrat.
Die wasserfreie Form wird durch die Darstellung einer violett-rot-Färbung gekennzeichnet; Während Hexahydrat, CRCL3.6h2Oder es ist dunkel grün. Der Einbau von Wassermolekülen verändert die physikalischen Eigenschaften dieser Kristalle; als Koch- und Fusionspunkte, Dichten usw.
 Violettflüssige Kristalle aus Chromchlorid (III) wasserfrei. Quelle: Ben Mills [Public Domain]
Violettflüssige Kristalle aus Chromchlorid (III) wasserfrei. Quelle: Ben Mills [Public Domain] Chromchlorid (III) (gemäß der Aktiennomenklatur) zersetzt sich bei hohen Temperaturen und wird zu Chromchlorid (II), CRCL2. Es ist für Metalle korrosiv, obwohl es im Chrom verwendet wird: Verfahren, bei dem Metalle mit einer dünnen Chromschicht bedeckt sind.
Die Cr3+, Wenn es aus seinem jeweiligen Chlorid kommt, wurde es bei der Behandlung von Diabetes verwendet, insbesondere bei Patienten mit totaler parenteraler Ernährung (TPN), die nicht die erforderliche Chrommenge aufnehmen. Die Ergebnisse sind jedoch viel besser (und zuverlässiger), wenn es als Picolinato geliefert wird.
[TOC]
Chromchloridstruktur
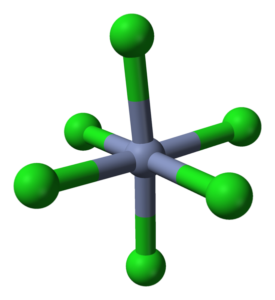 OctAedro -Koordination für CRCL3 in seinen Kristallen. Quelle: Ben Mills [Public Domain]
OctAedro -Koordination für CRCL3 in seinen Kristallen. Quelle: Ben Mills [Public Domain] Die CRCL3 Obwohl sie ein Salz sind, ist die Art ihrer Wechselwirkungen nicht rein ionisch; Sie haben einen bestimmten kovalenten Charakter, Produkt der Koordination zwischen CR3+ und Cl-, die zu einem deformierten Oktaeder führen (überlegenes Bild). Das Chrom befindet sich in der Mitte des OctAedro und der Chloros an seinen Eckpunkten.
Die Oktaeder CRCL6 Sie können auf den ersten Blick der CRCL -Formel widersprechen3; Dieses komplette Oktaeder definiert jedoch nicht die Einheitszelle des Glass, sondern einen Würfel (ebenfalls deformiert), der die grünen Kugeln oder Chloranionen in zwei Hälften schneidet.
Kann Ihnen dienen: 20 Beispiele für chemische Sublimation und EigenschaftenKristalline Schichten von wasserfreiem Schichten
Somit hält die einheitliche Zelle mit diesem Octaedro den Verhältnis 1: 3 weiterhin bei. Reproduktion dieser deformierten Würfel im Raum, der CRCL -Kristall wird erhalten3, das im überlegenen Bild mit einem dreidimensionalen Füllmodell und einem Modell von Kugeln und Balken dargestellt wird.
 CRCL3 -Kristallstrukturschicht, dargestellt mit einem dreidimensionalen Kugeln und Balkenmodell. Quelle: Ben Mills [Public Domain]
CRCL3 -Kristallstrukturschicht, dargestellt mit einem dreidimensionalen Kugeln und Balkenmodell. Quelle: Ben Mills [Public Domain] Diese kristalline Schicht ist eine der vielen, die machen3 (Verwechseln Sie die Farbe des Glass nicht mit der der grünen Kugeln).
Wie zu sehen ist, die Clanionen- Sie belegen die Oberfläche, so dass ihre negativen Belastungen die anderen kristallinen Schichten abwehren. Folglich werden die Kristalle Betrug und zerbrechlich; Aber brillant, wegen Chrom.
Wenn dieselben Schichten aus einer lateralen Perspektive sichtbar gemacht werden, wird sie anstelle von Oktaeder verzerrte Tetraheder beobachtet:
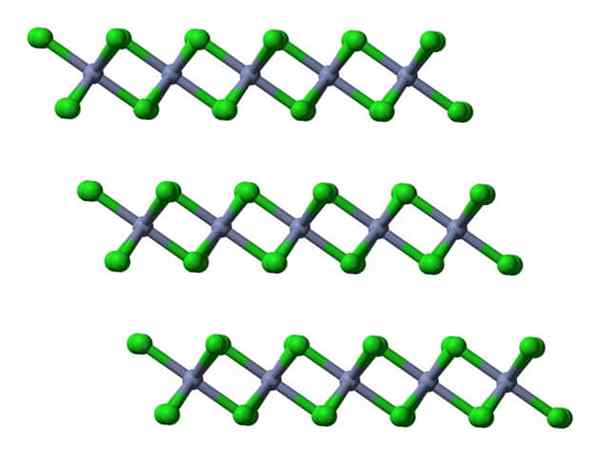 CRCL3 Kristalline Schichten Ansichten seitlich. Quelle: Ben Mills.
CRCL3 Kristalline Schichten Ansichten seitlich. Quelle: Ben Mills. Hier wird das Verständnis dafür, warum die Schichten miteinander abgestoßen werden- seiner Oberflächen.
Eigenschaften
Namen
-Chromchlorid (III)
-Chrom -Trichlorid (III)
-Chromchlorid (iii) wasserfrei.
Chemische Formel
-CRCL3 (wasserfrei).
-CRCL3.6h2O (hexahing).
Molekulargewicht
-158,36 g/mol (wasserfrei).
-266,43 g/mol (Hexahydrat).
Physische Beschreibung
-Feste und violett-rotistische Kristalle (wasserfrei).
-Dunkelgrün kristalliner Staub (Hexahydrat, unteres Bild). In diesem Hydrat kann es gesehen werden, wenn Wasser Helligkeit, Metallchrommerkmal hemmt.
 Hexahydratchrom Chrom. Quelle: Benutzer: Walkerma [Public Domain]
Hexahydratchrom Chrom. Quelle: Benutzer: Walkerma [Public Domain] Schmelzpunkt
-1.152 ºC (2.106 ºF, 1.425 K) (Anhydrum)
-83 ºC (Hexahydrat).
Siedepunkt
1300 ºC (2.370 ºF, 1.570) (Anhydrum).
Wasserlöslichkeit
 Wässrige Lösungen von Chromchlorid (III). Quelle: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Wässrige Lösungen von Chromchlorid (III). Quelle: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] -Etwas löslich (Anhydro).
-585 g/l (Hexahydrat).
Im oberen Bild wird eine Reihe von Testrohre mit einer wässrigen CRCL -Lösung gezeigt3. Beachten Sie, dass je konzentrierter, desto intensiver die Farbe des Komplexes [Cr (OH)2)6]3+, Grüne Farbe verantwortlich.
Kann Ihnen dienen: Putrescina: Struktur, Eigenschaften, Synthese, verwendetLöslichkeit in organischen Lösungsmitteln
Löslich in Ethanol, aber in Äther unlöslich (wasserfrei).
Dichte
-2,87 gr/cm3 (wasserfrei).
-2,76 g/cm3 (Hexahydrat).
Lagertemperatur
Zersetzung
Wenn Chromchlorid (III) auf Zersetzung erhitzt wird, emittiert er toxische Dämpfe von Chlorverbindungen, die Chlor enthalten. Diese Verbindungen werden auch freigesetzt, wenn Chromchlorid (III) mit starken Säuren in Kontakt kommt.
Korrosion
Es ist sehr ätzend und kann bestimmte Stähle angreifen.
Reaktionen
Es ist unvereinbar mit starken Oxidationsmitteln. Es reagiert auch stark mit Lithium und Stickstoff.
Wenn es in Gegenwart von Wasserstoff erhitzt wird, wird es mit der Bildung von Wasserstoffchlorid auf Chromchlorid (II) reduziert.
2 CRCL3 + H2 => 2 CRCL2 + 2 HCl
pH
In einer wässrigen Lösung und mit einer Konzentration von 0,2 m: 2,4.
Synthese
Chromchlorid (III) Hexahydrat wird produziert, wodurch Chromhydroxid mit Salzsäure und Wasser reagiert.
Cr (OH)3 + 3 HCl +3 h2O => crcl3.6h2ENTWEDER
Um Anhydra -Salz zu erhalten, wird die CRCL erhitzt3.6h2Oder in Gegenwart von Tionilo Chlorid, Socl2, Salzsäure und Hitze:
[Cr (h2ENTWEDER)6] Cl3 + 6Socl2 + ∆ → CRCL3 + 12 HCl + 6SO2
Alternativ die CRCL3 Chlorgas wird an einem Gemisch aus Chrom und Kohlenoxid erhalten.
Cr2ENTWEDER3 + 3 c +cl2 => 2 CRCL3 + 3 co
Und schließlich ist es die am häufigsten verwendete Methode, sein Oxid mit einem Halogenanzmittel wie Kohlenstofftetrachlorid zu erhitzen:
Cr2ENTWEDER3 + 3ccl4 + ∆ → 2Crcl3 + 3Cocl2
Anwendungen
Industrielle
Chromchlorid interveniert in die Einstellung von Chromchlorid (II); Reagenz, das in die Reduktion von Alkylhalogeniden und in die Synthese von Haluros von (e) -Alquenilo eingreift.
Kann Ihnen dienen: Natriumoxalat (Na2C2O4): Struktur, Eigenschaften, Verwendungsmöglichkeiten, Risiken-Es wird in der verchromten Technik verwendet. Dies besteht aus der Ablagerung durch Galvanoplastik, einer feinen Chromschicht auf Metallobjekten oder anderen Material.
-Es wird als Textil untergebracht, der als Zusammenhang zwischen dem Färbematerial und den zu färbenden Stoffen dient. Darüber hinaus wird es als Katalysator für die Herstellung von Olefinen und Abdichtungsmitteln verwendet.
Therapeutika
Die Verwendung von USP -Chromchlorid -Supplement wird bei Patienten empfohlen, die nur intravenöse Lösungen erhalten, die für die gesamte parenterale Ernährung (TPN) verabreicht werden, verabreicht werden. Daher nur, wenn diese Patienten nicht alle ihre Ernährungsbedürfnisse erhalten.
Chrom (III) ist Teil des Glukosetoleranzfaktors, einem Aktivator der durch Insulin geförderten Reaktionen. Es wird angenommen, dass Chrom (III) den Metabolismus von Glukose, Proteinen und Lipiden aktiviert und die Wirkung von Insulin beim Menschen und Tieren erleichtert.
Chrom ist in zahlreichen Lebensmitteln vorhanden. Seine Konzentration überschreitet jedoch 2 durch Ration nicht, wobei der Brokkoli die Nahrung mit größtem Beitrag ist (11 µg). Zusätzlich ist die Darmabsorption von Chrom niedrig, mit einem Wert von 0,4 bis 2,5% der aufgenommenen Menge.
Dies macht es schwierig, eine Diät für die Chromversorgung aufzubauen. 1989 empfahl die National Academy of Sciences zwischen 50 und 200 µg/Tag als angemessene Chromaufnahme.
Risiken
Zu den möglichen Risiken des Verbrauchs dieses Salzes als Chromergänzung gehören:
-Starke Magenschmerzen.
-Abnormale Blutungen, die sich von Schwierigkeiten zur Heilung einer Wunde, roten feinen Blutergüsse oder Verdunkelung des Stuhlprodukts der inneren Blutung unterscheiden können.
-Reizungen im Verdauungssystem, die Magengeschwüre oder Darms verursachen.
-Dermatitis
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Chrom (iii) Chlorid. Abgerufen von: in.Wikipedia.Org
- Chrom (III) Chlorid [PDF]. Erholt von: Alpha.Chem.Umb.Edu
- Pubchem. (2019). Chromchloridhexahydrat. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Nationales Gesundheitsinstitut. (21. September 2018). Chrom: Nahrungsergänzungsmittel Faktenblatt. Abgerufen von: SDG.Od.NIH.Regierung
- Tomlinson Carole a. (2019). Nebenwirkungen von Chromchlorid. Leaf Group Ltd. Erholt von: gesund.com
- « Warum ist es wichtig zu lesen? 10 Vorteile des Lesens
- Borax -Geschichte, Struktur, Eigenschaften, Verwendungen, Synthese, Risiken »

