Manganchlorideigenschaften, Struktur, Verwendungen, Risiken

- 3908
- 205
- Timo Rabenstein
Er Manganchlorid Es ist ein anorganisches Salz, dessen chemische Formel MCL ist2. Es besteht aus Mn -Ionen2+ und Cl- in einem Verhältnis von 1: 2; Für jedes Kation Mn2+ Es gibt zweimal von Cl -Anionen-.
Dieses Salz kann mehrere Hydrate bilden: MNCL2· 2H2Oder, (Dihydrat), mcl2· 4h2Oder (Tetrahydrat) und MCL2· 6h2Oder (Hexahydrat) Die häufigste Form von Salz ist Tetrahydrat.
 Rosa Manganchloridkristalle. Quelle: Ondřej Manggl [Public Domain]
Rosa Manganchloridkristalle. Quelle: Ondřej Manggl [Public Domain] Die physikalischen Eigenschaften von Manganchlorid wie Dichte, Schmelz- und Löslichkeitspunkt im Wasser werden durch ihren Hydratationsgrad beeinflusst. Zum Beispiel ist der Schmelzpunkt der Anhydra -Form viel größer als die der Tetrahydratform.
Die Farbe von Manganchlorid ist hellrosa (überlegenes Bild). Blende ist charakteristisch für Übergangsmetalle Salze. Manganchlorid ist eine schwache Lewis -Säure.
Das als Escacquita bekannte Mineral ist die natürliche wasserfreie Form von Manganchlorid (II); Wie die Kempita.
Manganchlorid (II) wird als Legierungsmittel verwendet; Katalysator bei Chlorierungsreaktionen usw.
[TOC]
Physikalische Eigenschaften
Aussehen
- Anhydra Form: rosa Kubikkristalle.
- Tetrahydratform: leicht empfindliche rötliche monokline Kristalle.
Molmassen
- Anhidro: 125.838 g/mol.
- Dihydrared: 161.874 g/mol.
- Tetrahydrat: 197,91 g/mol.
Fusionspunkte
- Anhidro: 654 ºC.
- Dihydrared: 135 ºC.
- Tetrahydrat: 58 ºC.
Siedepunkt
Anhidra Form: 1.190 ºC.
Dichten
- Wasserfrei: 2.977 g/cm3.
- Dihydrated: 2,27 g/cm3.
- Tetrahydrat: 2,01 g/cm3.
Wasserlöslichkeit
Anhydra Form: 63,4 g/100 ml bei 0 ºC; 73,9 g/100 ml bei 20 ºC; 88,5 g/100 ml bei 40 ° C; und 123,8 g/100 ml bei 100 ° C.
Löslichkeit in organischen Lösungsmitteln
Löslich in Pyridin und Ethanol, unlöslich in Äther.
Zersetzung
Sofern nicht vorhandene Vorsichtsmaßnahmen getroffen werden, kann die Dehydration hydratisierter Formen zu wasserfreier Form hydrolytische Dehydration verursachen, wobei die Produktion von Wasserstoffchlorid und Manganoxychlorid Produktion hergestellt wird.
pH
Eine 0,2 M -Lösung von Tetrahydrat -Manganchlorid in wässriger Lösung hat einen pH -Wert von 5,5.
Kann Ihnen dienen: ChromatogrammStabilität
Es ist stabil, aber empfindlich gegenüber Feuchtigkeit und inkompatibel mit starken Säuren, reaktiven Metallen und Wasserstoffperoxid.
Manganchloridstruktur
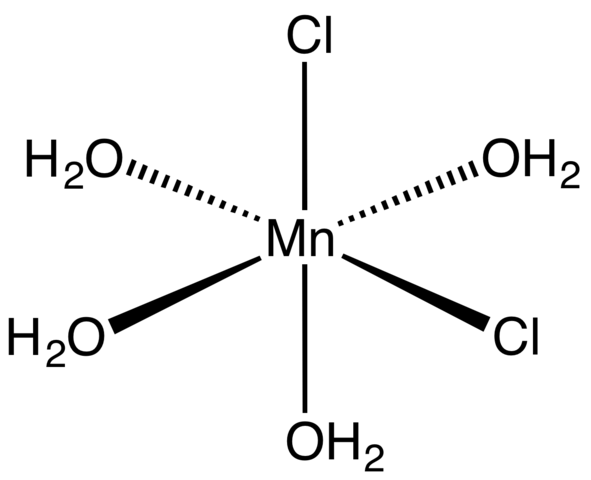 Koordinierungskomplex für MNCL2 Tetrahydrat. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Koordinierungskomplex für MNCL2 Tetrahydrat. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Beginnend mit Tetrahydrat -Salz-, Pink- und auffälligen Kristallen muss es aus Koordinationskomplexen (überlegenes Bild) bestehen. In ihnen das MN Metallic Center2+ ist von einem Oktaeder umgeben, das durch vier H -Moleküle definiert ist2Oder und zwei Clanionen-.
Beachten Sie, dass CL -Liganden- Sie sind in cis -Positionen; Alle sind in der rechteckigen Basis des OctAedro gleichwertig, und es spielt keine Rolle, ob der CL "bewegt" ist, "bewegt"- zu den anderen drei Positionen. Ein weiteres mögliches Isomer für dieses koordinierte Molekül ist, in dem beide CL- Sie sind in Transpositionen; Das heißt, an verschiedenen Enden (einer oben und der andere unten).
Die vier Wassermoleküle mit ihren Wasserstoffbrücken ermöglichen es zwei oder mehr Oktaeder, sich von Dipol-Dipolo-Kräften anzuschließen. Diese Brücken sind sehr richtungsfähig und addieren die elektrostatischen Wechselwirkungen zwischen dem MN2+ und Cl-, Sie stellen eine geordnete Struktur fest, die für einen Kristall charakteristisch ist.
Die rosa Farbe der MNCL2· 4h2Oder ist auf die elektronischen Übergänge des Mn zurückzuführen2+ und seine D -Konfiguration5. Ebenso verändern die durch die Nähe der Wassermoleküle und Chloride verursachten Störungen die erforderliche Energiemenge, die solche Elektronen absorbieren müssen5 Höhere Energieniveaus zu bereisen.
Dihydrat
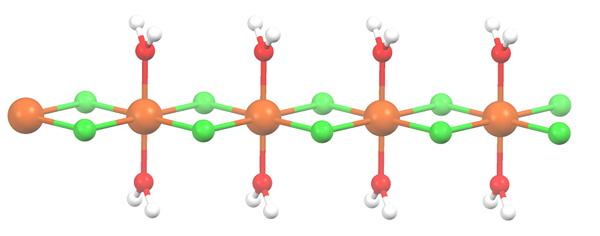 Polymerstruktur für MNCL2 · 2H2O. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Polymerstruktur für MNCL2 · 2H2O. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Salz hat dehydriert und seine Formel wird nun zu mcl2· 2H2ENTWEDER. Was passiert mit dem vorderen Oktaeder? Nichts, außer dass die zwei H -Moleküle2Oder dass sie aufgegeben werden, werden durch zwei CL ersetzt-.
Zuerst können Sie den falschen Eindruck erwecken, dass es vier CL gibt- Für jeden Mn2+; Die Hälfte des Oktaeders (axial) ist jedoch tatsächlich die sich wiederholende Einheit des Glass.
Daher ist es wahr, dass es ein Mn gibt2+ koordiniert bei zwei CL- und zwei Wassermoleküle in Transpositionen. Damit diese Einheit jedoch mit einem anderen interagieren kann, benötigt sie zwei CL -Brücken, die es wiederum ermöglichen, die Koordination Octaeder für die Mangan abzuschließen.
Kann Ihnen dienen: DiatomelementeZusätzlich zu den CL -Brücken arbeiten Wassermoleküle auch mit ihren Wasserstoffbrücken zusammen, sodass diese MNCL -Kette2· 2H2Oder nicht entwaffnen.
Wasserfrei
Schließlich hat Magnesiumchlorid das gesamte in seinen Kristallen enthaltene Wasser verloren; Sie haben jetzt Anhydra -Salz, MCL2. Ohne die Wassermoleküle verlieren die Kristalle die Intensität ihrer rosa Farben erheblich. Das Oktaeder wie für Hydrate bleibt die Mangan -Natur selbst unverändert.
Ohne Wassermoleküle die Mn2+ Enden, umgeben von einem Oktaeder, der nur aus CL besteht-. Diese Koordinationsverbindung hat sowohl einen kovalenten als auch einen ionischen Charakter; Aus diesem Grund bezieht es sich normalerweise auf die Struktur der MNCL2 Wie ein polymerer Kristall. Darin gibt es alternative Schichten von Mn und CL.
Nomenklatur
Mangan hat viele mögliche Oxidationszustände. Aus diesem Grund die traditionelle Nomenklatur für die MNCL2 Es wird nicht geklärt.
Andererseits entspricht das Manganchlorid seinem bekanntesten Namen, zu dem es fehlt, das "(ii)" hinzuzufügen, so dass es gemäß der Nomenklatur -Aktie ist: Manganchlorid (ii). Und Asçi ist die systematische Nomenklatur: Mangan -Dichlorid.
Anwendungen
Labor
Manganchlorid dient als Katalysator für die Chlorierung organischer Verbindungen.
Industrie
Manganchlorid wird als Rohstoff zur Ausarbeitung von Anti -Artisanten gegen Benzin verwendet. Schweißmaterial für nicht -ferroöse Metalle; Vermittler in Pigmentenausweisungen; Und Linaza Ölgetränk.
Es wird in der Textilindustrie zum Drucken verwendet und gefärbt; In der Herstellung mehrerer Mangansalze, einschließlich des Tricarbonil von Methylciclopentadienilmanganes, verwendet als Ziegelfarbstoff; und bei der Herstellung von getrockneten elektrischen Batterien.
Manganchlorid wird als Leichtmetallmittel verwendet und dem geschmolzenen Magnesium hinzugefügt, um Mangan-Magnesium-Legierungen zu produzieren. als Vermittler bei der Herstellung von Trocknern zum Malen und Lack; und als Bestandteil von Desinfektionsmitteln.
Kann Ihnen dienen: Natriumhydroxid (NaOH): Struktur, Eigenschaften, Verwendungszwecke, SyntheseEs wird auch in der Magnesiumreinigung verwendet.
Dünger und Tierfutter
Manganchlorid wird als Quelle für Mangan, Element verwendet, das zwar kein primäres Ernährungselement für Pflanzen wie Stickstoff, Phosphor und Kalium, in zahlreichen biochemischen Reaktionen dieser Lebewesen verwendet wird.
Es trägt auch zum Futter von Zuchttieren zur Versorgung von Mangan bei, ein wesentlicher Oligoement für das Wachstum von Tieren.
Manganchlorid ist eine diätetische Komponente, die Mangan versorgt, ein Element, das in zahlreichen für das Leben notwendigen Prozesse eingreift, darunter: Synthese von Fettsäuren und Sexualhormonen; Assimilation von Vitamin E; Knorpelproduktion; usw.
Risiken
Es kann durch Kontakt mit Hautrötung, Reizung und längerer Expositionsdermatitis erzeugt werden. Manganchlorid verursacht Rötung, Schmerz und Riss.
Durch Einatmen des Salzes, Halsschmerzen und Atemmangel. Andererseits könnte Erbrechen, Übelkeit und Durchfall auftreten.
Übermäßiger chronischer Inhalation dieses Salzes kann zu Lungenentzündungen und anschließenden reaktiven Erkrankungen der Atemwege führen.
Seine übermäßige Einnahme kann psychische Störungen, Dehydration, Hypotonie, Leber- und Nierenversagen, Multiorgan -Systemversagen und Tod verursachen.
Neurotoxizität ist die anfängliche Manifestation der unerwünschten Wirkung von Mangan, die in der Lage ist, Kopfschmerzen, Schwindel, Gedächtnisverlust, Hyperreflexie und mildes Zittern zu präsentieren.
Eine schwere Toxizität manifestiert sich bei Symptomen und Anzeichen wie bei der Parkinson -Krankheit, die ähnlich sind.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Mangan (ii) Chlorid. Abgerufen von: in.Wikipedia.Org
- Sky Spring Nanomaterialien. (2016). Manganchloridpulver. Erholt von: ssnano.com
- Chemisches Buch. (2017). Chlorid -Mangan. Erholt von: Chemicalbook.com
- Toxicology Data Network. (S.F.). Chlorid -Mangan. Toxnet. Wiederhergestellt von: Toxnet.NLM.NIH.Regierung
- Gérard Cahiez. (2001). Mangan (ii) Chlorid. doi.org/10.1002/047084289x.RM020
- Nationales Zentrum für Biotechnologie Information. (2019). Mangan -Dichlorid. Pubchem -Datenbank. CID = 24480. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Webconsultas Healthcare, s.ZU. (2019). Mineralien: Mangan. Erholt von: Web Consultas.com

