Reaktionenthalpie, Thermochemie, Übungen

- 1081
- 22
- Rieke Scheer
Der Reaktionenthalpie Es handelt sich um eine thermodynamische Funktion. Es ist definiert als interne Energie oder plus das Produkt des Drucks P nach Volumen V der Substanzen, die an einer chemischen Reaktion beteiligt sind, wie folgt: H = U + P ∙ V
Daher hat die Enthalpie Energieabmessungen und wird im internationalen Maßsystem in Joule gemessen. Um die Beziehung der Enthalpie mit dem in einer chemischen Reaktion ausgetauten Wärmebänder zu verstehen
 Abbildung 1. Bei der Verbrennung eines Gases nimmt die Enthalpie ab. Quelle: Pixabay
Abbildung 1. Bei der Verbrennung eines Gases nimmt die Enthalpie ab. Quelle: Pixabay Das erste Gesetz legt fest, dass die in einem thermodynamische Verfahren ausgetauschte Wärme gleich der Variation der inneren Energie der in den Prozess beteiligten Substanzen sowie den von diesen Substanzen im Prozess durchgeführten Arbeiten ist.
In jedem Prozess wird die Arbeit durch die folgende Beziehung berechnet:
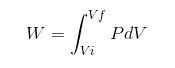
Im vorherigen Ausdruck VI ist das Anfangsvolumen, VF das endgültige Volumen und P der Druck. Wenn der Vorgang unter konstantem Druck P durchgeführt wird, wird die resultierende Arbeit lautet:
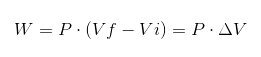
Wobei ΔV die Volumenvariation ist.
[TOC]
Definition
Chemische Reaktionen sind thermodynamische Prozesse, die im Allgemeinen unter konstantem Druck und sehr häufig bei atmosphärischem Druck auftreten. Diese Art von thermodynamischen Prozessen wird als "isobarisch" bezeichnet, da sie bei konstantem Druck auftritt.
In diesem Fall kann das erste Gesetz der Thermodynamik so geschrieben werden:
Qp = ΔU + p ∙ ΔV
Wobei QP angibt, dass Wärme bei konstantem Druck ausgetauscht wurde. Wenn die Definition von Enthalpie H = U + P ∙ V erhalten hat, dann:
Qp = ΔH
Von dort aus müssen Sie eine positive Enthalpie ändern, die eine Reaktion angibt. Dies ist eine endotherme Reaktion.
Kann Ihnen dienen: Tonne: Transformationen, Äquivalenzen und Übungen gelöstIm Gegenteil, wenn die Änderung der Enthalpie negativ ist, dann ist es eine exotherme Reaktion.
Tatsächlich kommt das Wort Enthalpie aus dem griechischen Wort Enthalpien, deren Bedeutung "Hitze" ist.
Häufig wird die Enthalpie auch als Hitze bezeichnet. Es muss jedoch klar sein, dass es nicht dasselbe wie Wärme ist, aber der Austausch von Wärme während des thermodynamischen Prozesses, der die Enthalpie verändert.
Wärmebeziehung
Im Gegensatz zur Wärme ist Enthalpy eine Zustandsfunktion. Wenn die Änderung der Enthalpie berechnet wird, wird die Differenz von zwei Funktionen, die ausschließlich vom Status des Systems wie interner Energie und Volumen abhängen, berechnet.
ΔH = ΔU + P ∙ ΔV
Wie bei der Reaktion bleibt der Druck konstant, so dass die Reaktionenthalpie eine Zustandsfunktion ist, die nur von der internen Energie und dem internen Volumen abhängt.
In einer chemischen Reaktion kann die Enthalpie der Reagenzien als die Summe der einzelnen von ihnen definiert werden; und die von Produkten als Summe der Enthalpie aller Produkte.
Die Änderung der Enthalpie in einer Reaktion ist der Unterschied der Produkte mit Ausnahme der der Reagenzien:
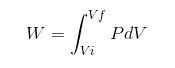
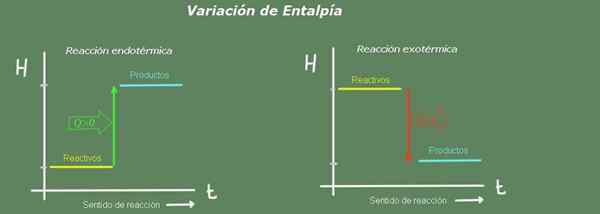 Figur 2. Enthalpiediagramm. Quelle: Selbst gemacht.
Figur 2. Enthalpiediagramm. Quelle: Selbst gemacht. In einer endothermen Reaktion ist die Enthalpie der Produkte größer als die der Reagenzien; Das heißt, die Reaktion nimmt Wärme aus der Umwelt ein. Im Gegenteil, in einer exothermen Reaktion ist die Enthalpie der Reagenzien größer als die der Produkte, da die Reaktion der Umwelt Wärme verleiht.
Standardenthalpie
Da die Änderung der Enthalpie in einer chemischen Reaktion von Druck und Temperatur abhängen kann, ist es üblich, die Standardreaktionsbedingungen zu definieren:
Es kann Ihnen dienen: Kalibrierungskurve: Wofür ist es, wie man es macht, BeispieleStandardreaktionstemperatur: 25 ° C.
Standard -Reaktionsdruck: 1 atm = 1 bar.
Standardenthalpie wird wie folgt bezeichnet: H °
Thermochemie
In einer thermochemischen Gleichung ist nicht nur Materie Reagenzien und Produkte, die Variation der Enthalpie ist auch wichtig. Enthalpie wird als Reaktion auf die Veränderung von ihr verstanden.
Lassen Sie uns beispielsweise die folgenden Reaktionen sehen:
2 H2 (Gas) + O2 (Gas) → 2 H2O (Flüssigkeit); ΔH ° = -571,6 kJ (exotherm).
H2 (Gas) + (½) O2 (Gas) → H2O (Flüssigkeit); ΔH ° = -285,8 kJ (exotherm).
2 H2O (Flüssigkeit) → 2 H2 (Gas) + O2 (Gas); ΔH ° = +571,6 kJ (Endotherme).
Enthalpie ist eine umfangreiche thermodynamische Menge
Wenn die Begriffe einer chemischen Gleichung durch einen bestimmten Faktor vervielfacht oder geteilt werden, wird die Enthalpie multipliziert oder dadurch geteilt.
Wenn die Reaktion investiert ist, wird auch das Vorzeichen der Reaktionsenthalpie investiert.
Gelöste Übungen
-Übung 1
C2H2 -Acetylengas wird aus der CAC2 -Calciumcarbid -Reaktion erhalten, die mit Wasser in Umwelt und Umweltdruck granuliert ist.
Als Daten gibt es Enthalpien der Reagenzierung Bildung:
ΔH ° (CAC2) = -59,0 kJ/mol
ΔH ° (H20) = -285,8 kJ/mol
Und die Enthalpie der Produktbildung:
ΔH ° (C2H2) = +227,0 kJ/mol
ΔH ° (Ca (OH) 2) = -986,0 kJ/mol
Finden Sie die Standard -Entropie der Reaktion.
Lösung
Das erste ist, die ausgewogene chemische Gleichung zu erhöhen:
CAC2 (s) + 2H20 (l) → Ca (OH) 2 (s) + C2H2 (g)
Und jetzt die Enthalpien der Reagenzien, Produkte und der Reaktion:
- Reagenzien: -59.0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kJ/mol
- Produkte: -986.0 kJ/mol + 227,0 kJ/mol = -759 kJ/mol
Es kann Ihnen dienen: Was sind Coplanares -Vektoren? (Mit gelösten Übungen)- Reaktion: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Es ist eine exotherme Reaktion.
-Übung 2
Wenn 1 Liter Acetylen unter Standardbedingungen brennt, wie viel Wärme löst sich es ab?
Lösung
Die Verbrennungsreaktion von Acetylen, die einst ausgeglichen ist, ist wie folgt:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (l)
Wir brauchen Enthalpien der Produktschulung:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (L)) = -285,8 kJ/mol
Berechnung von Enthalpien
Mit diesen Daten können wir die Enthalpie der Produkte berechnen:
ΔH ° (Produkte) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol
Und die Reagenzierungenthalpie:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (O2) = 0,0 kJ/mol
Die Enthalpie der Reagenzien wird:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol
Die molare Reaktionenthalpie lautet dann: ΔH ° (Produkte) - ΔH ° (Reagenzien) = -1072,8KJ/Mol - 227,0 kJ/mol = -1299,8 kJ/mol
Verbrennung Enthalpie
Jetzt müssen wir wissen, wie viele Mol Acetylen ein Liter von Acetylen unter Standardbedingungen sind. Dazu werden wir die Zustandsgleichung eines idealen Gases verwenden, aus dem wir die Anzahl der Maulwürfe löschen werden.
Anzahl der Mol n = p*v/(r*t)
P = 1 atm = 1,013 x 10⁵ pa
V = 1 l = 1,0 x 10^-3 m³
R = 8,31 j/(mol*k)
T = 25 ° C = 298,15 K
N = 0,041 mol
Die Enthalpie der Verbrennung von 1 Liter Acetylen beträgt 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
Das negative Vorzeichen zeigt an, dass es sich um eine exotherme Reaktion handelt, die 53,13 kJ = 12,69 kcal ergibt.
Verweise
- Castaños e. Enthalpie bei chemischen Reaktionen. Erholt von: Lidiaconlachimica.WordPress.com
- Thermochemie. Reaktionenthalpie. Abgerufen aus: Ressourcen.Ausbildung.Ist
- Thermochemie. Definition der Standardreaktionenthalpie. Erholt von: Quimitube.com
- Wikipedia. Standardreaktion Enthalpie. Erholt von: Wikipedia.com
- Wikipedia. Ausbildung Enthalpie. Erholt von: Wikipedia.com
- « Relative Fehlerformeln, wie es berechnet wird, Übungen
- Was ist der Auftragsaufwand und wie man sie erhält?? »

