Absorptionsspektrum

- 4240
- 1184
- Rieke Scheer
 Sichtbares Lichtspektrum. Quelle: Wikimedia Commons
Sichtbares Lichtspektrum. Quelle: Wikimedia Commons Was ist ein Absorptionsspektrum?
A Absorptionsspektrum Es ist das Produkt der Wechselwirkung des Lichts mit einem Material oder einer Substanz in einem seiner physischen Zustände. Die Wechselwirkung umfasst ein breites Segment des Wellenlängenbereichs und der Energie der elektromagnetischen Strahlung.
Mit anderen Worten, das Absorptionsspektrum spiegelt diesen Teil der elektromagnetischen Strahlung wider, die ein bestimmtes Material in einem Frequenzbereich absorbiert.
In diesem Sinne können einige Feststoffe, Flüssigkeiten oder Gase Photonen verschiedener Energien oder Wellenlängen absorbieren, von ultraviolett.
Das menschliche Auge nimmt nur die Wechselwirkungen der Materie mit sichtbarem Licht wahr. Es ist auch in der Lage, die Beugung von weißem Licht durch ein Prisma oder ein Medium in seinen farbenfrohen Komponenten zu betrachten (überlegenes Bild).
Wenn der Lichtstrahl nach einem Material durch ein Material "gefangen" und analysiert wird, würde das Fehlen bestimmter farbiger Bänder gefunden. Das heißt, schwarze Streifen würden beobachtet, wie sie mit seinem Hintergrund kontrastieren würden.
Dies ist das Absorptionsspektrum, und seine Analyse ist von grundlegender Bedeutung für die instrumentelle analytische Chemie und Astronomie.
Atomabsorption
Im oberen Bild wird ein typisches Absorptionsspektrum der Elemente oder Atome gezeigt. Beachten Sie, dass schwarze Streifen die absorbierten Wellenlängen darstellen, während die anderen emittiert werden. Dies bedeutet, dass im Gegenteil ein atomisches Broadcast -Spektrum wie eine schwarze Band mit emittierten Farben aussehen würde.
Aber was sind diese Streifen?? Wie man weiß, ob Atome absorbieren oder ausgehen (ohne Fluoreszenz oder Phosphoreszenz einzuführen)? Die Antworten befinden sich in den elektronischen Zuständen, die von Atomen zulässig sind.
Kann Ihnen dienen: Mindestformel: So erhalten Sie die Mindestformel, Beispiele und ÜbungenElektronische Übergänge und Energie
Die Elektronen können sich vom Kern entfernen und sie positiv beladen lassen, während sie von einem orbitalen Umlauf mit niedrigerer Energie zu einer größeren Energie wandelt. Um dies durch die durch Quantenphysik erklärte, absorbieren Sie Photonen spezifischer Energie, um den elektronischen Übergang durchzuführen.
Daher wird Energie quantisiert und absorbiert nicht Medium oder drei Viertel eines Photons, sondern die Frequenzwerte (ν) oder Betonwellenlängen (λ).
Sobald das Elektron angeregt ist, bleibt es im elektronischen Zustand größerer Energie nicht unbegrenzt. Lassen Sie Energie in Form eines Photons frei, und das Atom kehrt in seinen basalen oder ursprünglichen Zustand zurück.
Je nachdem, ob absorbierte Photonen aufgezeichnet sind, wird ein Absorptionsspektrum vorhanden sein. Und wenn die ausgegebenen Photonen aufgezeichnet werden, ist das Ergebnis ein Emissionsspektrum.
Dieses Phänomen kann experimentell beobachtet werden, wenn weiche oder atomisierte Proben von einem Element erhitzt werden. In der Astronomie kann der Vergleich dieser Spektren die Zusammensetzung eines Sterns bekannt sein und sogar deren Ort in Bezug auf die Erde im Zusammenhang mit der Erde.
Sichtbares Spektrum
Wie auf dem Bild zu sehen ist, enthält das sichtbare Spektrum Farben von Violett bis Rot und all seinen Schattierungen in Bezug auf die Absorption des Materials (dunkle Nuancen).
Die Wellenlängen des roten Lichts entsprechen den Werten von 650 nm (bis sie in Infrarotstrahlung verschwindet).
Und am linken Ende bedecken die violett- und lila Töne die Wellenlängenwerte bis zu 450 nm. Das sichtbare Spektrum deckt dann von 400 bis ca. 700 nm ab.
Wenn λ zunimmt, nimmt die Häufigkeit des Photons ab und damit seine Energie. Somit hat violettes Licht mehr Energie (niedrigere Wellenlängen) als rotes Licht (höhere Wellenlängen).
Kann Ihnen dienen: Brom: Geschichte, Struktur, elektronische Konfiguration, Eigenschaften, verwendetEin Material, das lila Licht absorbiert, impliziert daher elektronische Übergänge größerer Energien.
Wenn das Material die violette Farbe absorbiert, trägt es eine grünlich gelbe Farbe, was bedeutet, dass seine Elektronen sehr Energieübergänge durchführen. Und wenn das Material die rote Farbe weniger Energie absorbiert, reflektiert es eine bläulichgrüne Farbe.
Wenn ein Atom sehr stabil ist, zeigt es normalerweise sehr entfernte elektronische Zustände in Energie und muss daher Photonen mit größerer Energie absorbieren, um elektronische Übergänge zu ermöglichen:
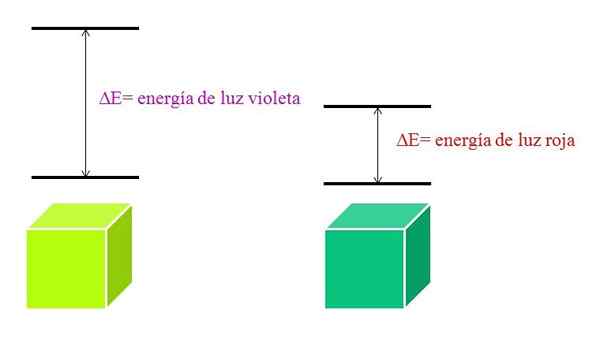 Schema der Energien von violettem Licht und rotem Licht. Quelle: Gabriel Bolívar
Schema der Energien von violettem Licht und rotem Licht. Quelle: Gabriel Bolívar Moleküle -Absorptionsspektrum
Die Moleküle haben Atome, die auch elektromagnetische Strahlung absorbieren. Ihre Elektronen sind jedoch Teil der chemischen Bindung, daher sind ihre Übergänge unterschiedlich. Einer der großen Triumphe der molekularen Orbitalentheorie ist es, die Absorptionsspektren mit der chemischen Struktur in Beziehung zu setzen.
So haben einfache, doppelte, dreifache, konjugierte Verbindungen und aromatische Strukturen ihre eigenen elektronischen Zustände, die sehr spezifische Photonen absorbieren.
Durch das Besitz von mehreren Atomen, zusätzlich zu den intermolekularen Wechselwirkungen und den Schwingungen ihrer Verbindungen (die auch Energie absorbieren), haben die Moleküle -Absorptionsspektren die Form der „Berge“, die die Banden angeben, die die Wellenlängen enthalten, in denen elektronische Übergänge übertragen werden.
Dank dieser Spektren kann eine Verbindung charakterisiert, identifizieren und sogar durch multivariate Analyse quantifizieren.
Methylenblau
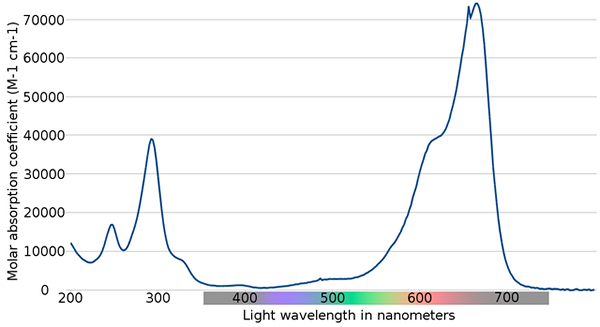 Methylenblau -Spektrum. Quelle: Wikimedia Commons
Methylenblau -Spektrum. Quelle: Wikimedia Commons Im oberen Bild ist das Spektrum des blauen Methylenindikators gezeigt. Wie der Name betont, ist es blau, kann es aber mit seinem Absorptionsspektrum überprüft werden?
Kann Ihnen dienen: physische VeränderungenBeachten Sie, dass zwischen den Wellenlängen von 200 und 300 nm Bänder bestehen. Zwischen 400 und 500 nm gibt es fast keine Absorption, das heißt, es absorbiert nicht die violetten, blauen oder grünen Farben.
Es zeigt jedoch ein intensives Absorptionsband nach 600 nm und weist daher elektronische Übergänge mit geringer Energie auf, die rote Lichtphotonen absorbieren.
Infolgedessen zeigt Methylenblau eine intensive blaue Farbe.
Chlorophile A und B
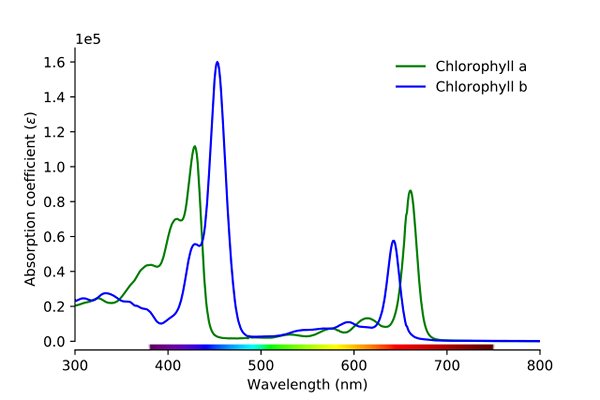 Chlorophyll -Absorptionsspektrum A und B. Quelle: Wikimedia Commons
Chlorophyll -Absorptionsspektrum A und B. Quelle: Wikimedia Commons Wie auf dem Bild zu sehen ist, entspricht die grüne Linie dem Chlorophyll A Absorptionsspektrum, während die blaue Linie der von Chlorophyll B entspricht.
Erstens die Bänder, in denen die molaren Absorptionen höher sind, in diesem Fall diejenigen, die links sind, zwischen 400 und 500 nm. Chlorophyll a intensiv absorbierende lila Farben, während Chlorophyll B (blaue Linie) es mit blauer Farbe macht.
Durch das Absorbieren von Chlorophyll B um 460 nm (blau) wird die gelbe Farbe reflektiert. Andererseits absorbiert es auch intensiv, etwa 650 nm, orangefarbenes Licht, was bedeutet, dass es die Farbe Blau zeigt. Wenn Gelb und Blau gemischt sind, führt dies zu einer grünen Farbe.
Und schließlich absorbiert Chlorophyll A die bläuliche violette Farbe und auch ein rotes Licht um 660 nm. Daher zeigt es eine grüne "weiche" Farbe durch Gelb.
Verweise
- Observatoire de Paris (s.F.). Die verschiedenen Arten von Spektren. Durchschnittlich abgerufen.OSPPM.fr
- Ranals University Campus (s.F.). Spektrophometrie: Absorptionsspektren und kolorimetrische Quantifizierung von Biomolekülen. UCO erholte sich.Ist

