Schrödinger Atommodell
- 1371
- 28
- Medine Kedzierski
Was ist Schrödinger -Atommodell??
Er Schrödinger Atommodell Es ist ein Vorschlag für den Betrieb und die Struktur des von Erwin Schrödinger im Jahr 1926 entwickelten Atoms. Es ist als quantenmechanisches Modell des Atoms bekannt und beschreibt das Wellenverhalten des Elektrons.
Dafür basierte der herausragende österreichische Physiker auf der Broglie -Hypothese, die angab.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger schlug vor, dass die Bewegung von Elektronen im Atom der Dualität der Wellenpartikel entsprach, und folglich konnten sich die Elektronen als stationäre Wellen um den Kern mobilisieren.
Schrödinger, der 1933 für seine Beiträge zur Atomtheorie mit dem Nobelpreis ausgezeichnet wurde.
Schrödinger Atommodelleigenschaften
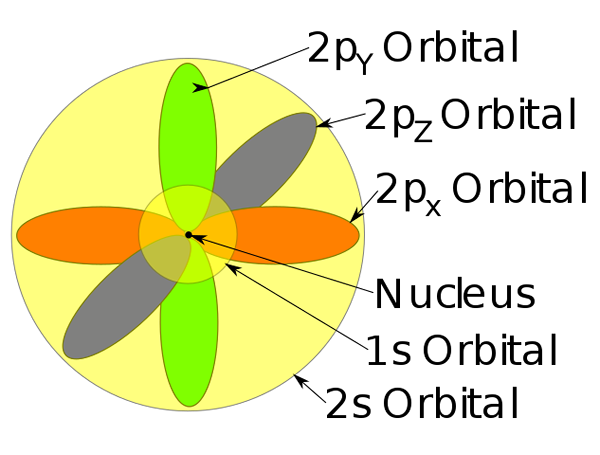 Orbitale 1s, 2s und 2p in einem Natriumatom.
Orbitale 1s, 2s und 2p in einem Natriumatom. -Dieses Atommodell beschreibt die Bewegung von Elektronen als stationäre Wellen.
-Die Elektronen bewegen sich ständig, dh sie haben keine feste oder definierte Position innerhalb des Atoms.
-Dieses Modell prognostiziert weder den Elektronenort noch beschreibt es die Route, die es innerhalb des Atoms macht. Legt nur eine Wahrscheinlichkeitszone fest, um das Elektron zu lokalisieren.
-Diese Wahrscheinlichkeitsbereiche werden als Atomorbitale bezeichnet. Die Orbitale beschreiben eine Übersetzungsbewegung um den Kern des Atoms.
-Diese atomaren Orbitale haben unterschiedliche Niveaus und Energie -Sub -Levels und können zwischen Elektronenwolken definiert werden.
-Das Modell betrachtet nicht die Stabilität des Kern.
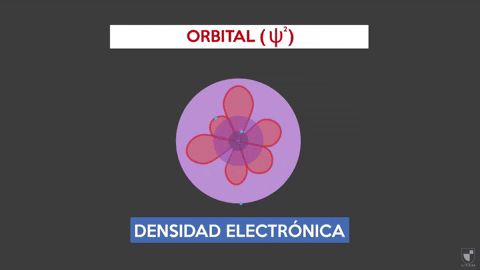 Die elektronische Dichte zeigt die Wahrscheinlichkeit an, ein Elektron in der Nähe des Kerns zu finden. Je näher des Kerns (lila Zone) es mehr Wahrscheinlichkeit gibt, während es geringer ist, wenn Sie sich vom Kern (violettes Bereich) entfernen, weniger.
Die elektronische Dichte zeigt die Wahrscheinlichkeit an, ein Elektron in der Nähe des Kerns zu finden. Je näher des Kerns (lila Zone) es mehr Wahrscheinlichkeit gibt, während es geringer ist, wenn Sie sich vom Kern (violettes Bereich) entfernen, weniger. Experiment
Schrödingers Atommodell basiert auf der Broglie -Hypothese sowie auf den vorherigen Atommodellen von Bohr und Sommerfeld.
Kann Ihnen dienen: dynamische oder kinetische Reibung: Koeffizient, Beispiele, ÜbungenBroglie schlug vor, dass genau wie Wellen Partikel haben, Partikel Welleneigenschaften und eine zugehörige Wellenlänge haben. Etwas, das zu dieser Zeit viel Erwartung erzeugte, war Albert Einstein selbst in seiner Theorie.
Broglies Theorie hatte jedoch einen Mangel, das war, dass die Bedeutung der eigenen Idee nicht sehr gut verstanden wurde: Ein Elektron kann eine Welle sein, aber was ist mit was mit was? Dann scheint die Figur des Schrödinger zu antworten.
Zu diesem Zweck stützte sich der österreichische Physiker auf Young's Experiment und entwickelte basierend auf seinen eigenen Beobachtungen den mathematischen Ausdruck, der seinen Namen trägt.
Als nächstes die wissenschaftlichen Grundlagen dieses Atommodells:
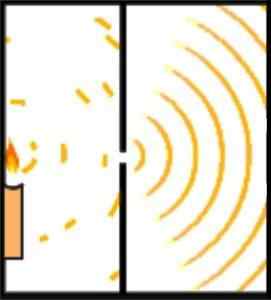
Young's Experiment: Die erste Demonstration der Wellenpartikel-Dualität
Broglies Hypothese über die wellige und korpuskuläre Natur des Subjekts kann durch Young's Experiment demonstriert werden.
Der englische Wissenschaftler Thomas Young legte die Grundlagen des Schrödinger -Atommodells, als er 1801 das Experiment durchführte, um die wellige Natur des Lichts zu verifizieren.
Während seines Experimentierens teilte Young die Emission eines Lichtstrahls, der ein kleines Loch durch eine Beobachtungskammer kreuzt. Diese Abteilung wird durch die Verwendung einer 0,2 -Millimeter -Karte erreicht, die parallel zum Strahl liegt.
Das Design des Experiments wurde durchgeführt, damit der Lichtstrahl breiter als die Karte ist, wodurch die Karte horizontal platziert wurde, wurde der Strahl in ungefähr die gleichen Teile unterteilt. Der Ausgang der Lichtstrahlen wurde von einem Spiegel gerichtet.
Kann Ihnen dienen: EntfernungskräfteBeide Lichtstrahlen trafen eine Wand in einem dunklen Raum. Dort wurde das Interferenzmuster zwischen den beiden Wellen gezeigt, was gezeigt wurde, dass sich das Licht genauso wie ein Teilchen und eine Welle verhalten konnte.

Ein Jahrhundert später verstärkte Albert Einsten die Idee durch die Prinzipien der Quantenmechanik.
Schrödinger's Gleichung
Schrödinger entwickelte zwei mathematische Modelle und unterschieden, was passiert, je nachdem, ob sich der Quantenzustand im Laufe der Zeit ändert oder nicht.
Für die Atomanalyse veröffentlichte Schrödinger Ende 1926.
Dies impliziert, dass sich die Welle nicht bewegt, ihre Knoten, dh ihre Gleichgewichtspunkte, als Drehzahl für den Rest der Struktur, um sich um sie herum zu bewegen, und beschreibt eine bestimmte Frequenz und Amplitude.
Schrödinger definierte die Wellen, die Elektronen als stationäre oder Orbitalzustände beschreiben, und sind wiederum auf unterschiedlichen Energieniveaus verbunden.
Schrödingers unabhängige Zeitgleichung lautet wie folgt:
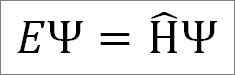
Wo:
UND: Proportionalitätskonstante.
Ψ: Quantensystemwellenfunktion.
Η ̂: Hamiltonianer Betreiber.
Die unabhängige Zeitgleichung des Schrödinger wird verwendet, wenn das Beobachtbare, das die Gesamtenergie des Systems darstellt, der als Hamiltonschen Operator bezeichnet wird, nicht von der Zeit abhängt. Die Funktion, die die Gesamtwellenbewegung beschreibt, hängt jedoch immer von der Zeit ab.
Schrödingers Gleichung gibt an, dass, wenn Sie eine Wellenfunktion ψ haben und der Hamiltonsche Operator darauf handelt.
Es kann Ihnen dienen: Diskrete Variable: Eigenschaften und BeispieleAngewendet auf das Atommodell von Schrödinger, wenn sich das Elektron in einem definierten Raum bewegt, gibt es diskrete Energiewerte, und wenn das Elektron im Weltraum frei verschoben wird, sind kontinuierliche Energieintervalle aufgetreten.
Aus mathematischer Sicht gibt es mehrere Lösungen für die Schrödinger -Gleichung, jede Lösung impliziert einen anderen Wert für die Verhältnismäßigkeitskonstante und.
Nach Heisenbergs Unsicherheitsprinzip ist es nicht möglich, die Position oder Energie eines Elektrons abzuschätzen. Infolgedessen erkennen Wissenschaftler, dass die Schätzung der Elektronenstelle innerhalb des Atoms ungenau ist.
Postulate des Schrödinger -Atommodells
Die Postulate des Schrödinger -Atommodells sind die folgenden:
-Die Elektronen verhalten sich als stationäre Wellen, die gemäß der Wellenfunktion ψ im Raum verteilt sind.
-Die Elektronen bewegen sich innerhalb des Atoms und beschreiben Orbitale. Dies sind Bereiche, in denen die Wahrscheinlichkeit, ein Elektron zu finden, erheblich höher ist. Die oben genannte Wahrscheinlichkeit ist proportional zum Quadrat der Wellenfunktion ψ2.
Die elektronische Konfiguration des Schröddinguer -Atommodells erklärt die periodischen Eigenschaften von Atomen und Verbindungen, die bilden.
Das Atommodell von Schrödinger betrachtet jedoch nicht den Spin von Elektronen und berücksichtigt jedoch nicht die Variationen von schnellen Elektronen aufgrund relativistischer Effekte aufgrund relativistischer Effekte.
Artikel von Interesse
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atommodell.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo -Atommodell.
BOHR -Atommodell.
Sommerfeld Atommodell.
Aktuelles Atommodell.
Verweise
- Das quantenmechanische Modell des Atom.Khan Akademie.Org
- Schrödingers Wellengleichung (s).F.). Jaime I Universität. Castellón, Spanien. Erholt von: uji.Ist
- Moderne Atomtheorie: Modelle. © ABCTE. Erholt von: ABCTE.Org
- Schrodingers Atommod.F.). Erholt von: Erwinschrodingerbiographie.Weebly.com
- Wikipedia, freie Enzyklopädie. Schrödinger Gleichung. Geborgen von: ist.Wikipedia.Org
- Wikipedia, freie Enzyklopädie. Junges Experiment. Geborgen von: ist.Wikipedia.Org

