Radsporteigenschaften, Reaktionen, Verwendungen, Beispiele
- 3399
- 1035
- Ibrahim Steuk
Der Cycloalcanos Sie sind eine Familie von gesättigten Kohlenwasserstoffen mit einer allgemeinen Formel von CNH2n das fällt mit der der Alkene zusammen; Mit dem Unterschied, dass die scheinbare Unsättigung nicht auf eine Doppelbindung zurückzuführen ist, sondern auf einen Ring oder Zyklus. Deshalb gelten sie als Alquenos -Isomere angesehen.
Diese werden gebildet, wenn sich lineare Alkane die Enden ihrer Ketten vereinen, um eine geschlossene Struktur zu stammen. Wie bei den Alkanen kann der Cycloalcan unterschiedliche Größen, Molekülmassen, Substitutionen oder sogar Systeme aus mehr als einem Ring aufweisen (Polycyclicals).
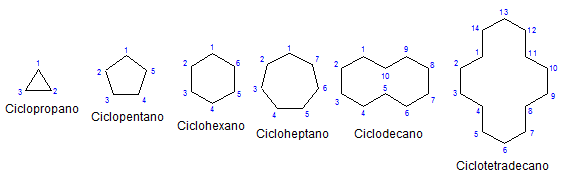
 Einige monocyclische Cycloalcanos. Quelle: Mephisto Spa über Wikipedia.
Einige monocyclische Cycloalcanos. Quelle: Mephisto Spa über Wikipedia. Der anderen Chemie und physisch ähneln sie den Alkanen. Sie haben nur Kohlenstoffe und Wasserstoffe, sie sind neutrale Moleküle und interagieren daher durch Van der Wände Kräfte. Sie dienen auch als Kraftstoffe und geben Wärme frei, wenn sie in Gegenwart von Sauerstoff verbrennen.
Warum sind Cycloalcanos instabiler als ihre Open -Chain -Gegenstücke?? Der Grund kann vermutet werden, indem die im oberen Bild dargestellten Beispiele von Cycloalcanos beobachtet werden: Es gibt sterische (räumliche) Spannungen und Hindernisse.
Beachten Sie, dass je weniger Kohlenstoffe (in Blau aufgeführt) sind, desto geschlossener ist die Struktur; Und das Gegenteil geschieht, wenn sie zunehmen, und dreht sich wie eine Halskette.
Kleine Cycloalcanos sind gasförmig, und wenn ihre Größen ihre intermolekularen Kräfte erhöhen. Folglich können sie flüssig sein, die in der Lage sein können, Fette und apolare, Schmiermittel oder Feststoffe aufzulösen, die dunkle Farben und Eigenschaften wie Asphaltfarben aussehen.
[TOC]
Physikalische und chemische Eigenschaften
Polarität
Wenn es nur aus Kohlenstoffen und Wasserstoffen besteht, Atome, die sich in der Elektronegativität nicht zu stark unterscheiden.
Sie können nicht durch Dipol-Dipolkräfte interagieren, aber sie hängen speziell von Londons Kräften ab, die schwach sind, die jedoch mit der molekularen Masse zunehmen. Deshalb sind kleine Cycloalcanos (mit weniger als fünf Kohlenstücken) gasförmig.
Intermolekulare Wechselwirkungen
Auf der anderen Seite haben Cycloalcanos, da sie Ringe sind. Somit sind sie gruppiert und interagieren besser im Vergleich zu Alkanen; Und daher sind seine Kochen- und Fusionspunkte höher.
Auch da sie zwei weniger Wasserstoffatome haben (CNH2n Für Cycloalcanos und cNH2n+2 Für Alkane) sind sie leichter; Und dies verringert das Volumen, das durch seine Moleküle besetzt ist, und daher sind sie dichter.
Sättigung
Warum sind Cycloalcanos als gesättigte Kohlenwasserstoffe klassifiziert?? Weil sie haben, wie sie ein Wasserstoffmolekül integrieren; Es sei denn, der Ring öffnet sich und in diesem Fall würden sie einfache Alkane werden. Damit ein Kohlenwasserstoff als gesättigt angesehen wird.
Es kann Ihnen dienen: Potentiometer (Phameter)Stabilität
Chemisch sind sie Alkanen sehr ähnlich. Beide haben C-C- und C-H-Links, die nicht so einfach zu brechen sind, um andere Produkte zu verursachen. Ihre relative Stabilität unterscheidet sich jedoch, was experimentell durch Messung ihrer Verbrennungswärme (ΔHKamm).
Zum Beispiel im Vergleich der ΔHKamm Für Propan und Cyclopropo (dargestellt durch ein Dreieck im Bild) gibt es 527,4 kcal/mol bzw. 498,9 kcal/mol.
Das Detail ist, dass das CyclopropanKamm Minor (471 kcal/mol), weil es drei Methylengruppen ist, Cho2; In Wirklichkeit füllt es jedoch mehr Wärme, was die Instabilität, die größer ist als die geschätzten, widerspiegelt. Diese überschüssige Energie wird gesagt, dass sie auf Spannungen im Ring zurückzuführen ist.
Tatsächlich regieren und differenzieren diese Spannungen die Reaktivität oder Stabilität der Cycloalcanos in Bezug auf die Alkane gegen spezifische Reaktionen. Solange die Spannungen nicht sehr hoch sind, sind die Cycloalcanos tendenziell stabiler als ihre jeweiligen Oberteile.
Nomenklatur
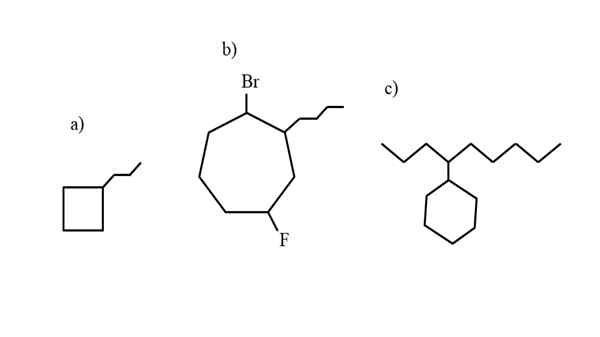 Einige Beispiele für ersetzte Cycloalcan zum Testen der Nomenklaturregeln. Quelle: Gabriel Bolívar.
Einige Beispiele für ersetzte Cycloalcan zum Testen der Nomenklaturregeln. Quelle: Gabriel Bolívar. Die Nomenklatur, die vom IUPAC für die Cycloalcanos bestimmt wird, unterscheidet sich nicht zu sehr als die der Alkane. Die einfachste Regel von allen ist, das Zykluspräfix auf den Namen des Alkans zu platzieren, dessen Cycloalcano gebildet wird.
So zum Beispiel des N-Hexane, Cho3CH2CH2CH2CH2CH3, Cyclohexan wird erhalten (dargestellt durch ein Sechseck im ersten Bild). Ebenso wie es mit Cyclopropan, Cyclobutan usw. passiert, usw.
Jetzt können diese Verbindungen Substitutionen von einem ihrer Hydrogene leiden. Wenn die Anzahl der Kohlenstoffe des Rings höher ist als die des Mietsubstituenten, wird der Ring als Hauptkette genommen. Dies ist der Fall a) für das überlegene Bild.
Beachten Sie, dass in a) der Cyclobutan (das Quadrat) mehr Kohlenstoffe hat als die damit verbundene Propilus -Gruppe; Dann wird diese Verbindung als Propylciclobutano bezeichnet.
Wenn es mehr als einen Substituenten gibt, sollten sie in alphabetischer Reihenfolge und so genannt werden, dass sie die geringste Lokatorzahl haben. Zum Beispiel wird b): 1-Brom-4-Fluor-2-Butilcicloheptano genannt (und nicht 1-Brom-5-Fluor-7-Butylcicloheptano, was falsch wäre).
Und schließlich, wenn der alquilische Substituent mehr Kohlenstoff als den Ring hat, wird dann gesagt, dass letzteres die Ersatzgruppe der Hauptkette ist. Somit heißt c): 4-Cyclohexilnonano.
Kann Ihnen dienen: MetalloxideStruktur
Abgesehen von den ersetzten Zykanern ist es bequem, sich nur auf ihre Strukturbasis zu konzentrieren: die Ringe. Diese wurden im ersten Bild dargestellt.
Bei der Beobachtung kann die falsche Idee auftreten, dass solche Moleküle flach sind; Mit Ausnahme von Cyclopropo sind seine Oberflächen jedoch "Zickzagenantes", wobei Kohlenstoffe nach unten gehen oder in Bezug auf dieselbe Ebene hochladen.
Dies liegt daran, dass alle Kohlenstoffe zu starten sind3, und präsentieren daher tetraedrische Geometrien mit 109,5º -Verbindungswinkeln. Aber wenn die Geometrie der Ringe sorgfältig beobachtet wird, ist es für ihre Winkel unmöglich; Zum Beispiel betragen die Winkel innerhalb des Cyclopropan -Dreiecks 60º.
Dies ist das, was als Winkelspannung bekannt ist. Je größer die Ringe sind, der Winkel zwischen den C-C-Glieder liegt näher bei 109,5º.
Ein weiteres Beispiel ist im Cyclobutan, dessen Verbindungswinkel 90º betragen. Bereits im Cyclopentano betragen seine Winkel 108 °, und vom Cyclohexan wird dann gesagt, dass die Winkelspannung aufhört, einen solchen so bemerkenswerten Effekt auszuüben.
Konformationen
Zusätzlich zur Winkelspannung gibt es andere Faktoren, die zur Spannung von Cycloalcanos beitragen.
C-C-Verbindungen können nicht ohne mehr drehen, da dies bedeuten würde, dass die gesamte Struktur "schaudern". Somit können diese Moleküle sehr gut definierte räumliche Konformationen annehmen. Der Zweck dieser Bewegungen ist es, die in der Sonnenfinsternis von Wasserstoffatomen verursachten Spannungen zu verringern. das heißt, wenn einer vor dem anderen.
Zum Beispiel ähneln Konformationen für den Cyclobutan einem Schmetterling, der seine Flügel schlägt; die des Cyclopentano, ein Umschlag; Diejenigen des Cyclohexan, eines Bootes oder Stuhls und je größer der Ring, desto größer ist die Anzahl und die Formen, die sie im Weltraum anwenden können.
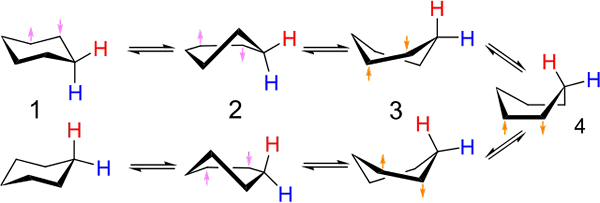 Investitionen zwischen Stuhl- und Bootstypkonformation für das Cyclohexan. Quelle: Kministi [CC0].
Investitionen zwischen Stuhl- und Bootstypkonformation für das Cyclohexan. Quelle: Kministi [CC0]. Das überlegene Bild zeigt ein Beispiel für solche Konformationen für das Cyclohexan. Beachten Sie, dass das mutmaßliche flache Sechseck mehr wie ein Stuhl (links vom Bild) oder ein Boot (rechts) eher wie ein Stuhl zu sein scheint. Ein Wasserstoff wird mit roten Texten und einem anderen mit blauen Texten dargestellt, um anzuzeigen, wie sich ihre relativen Positionen nach Investitionen verändern.
In (1), wenn Wasserstoff senkrecht zur Ringebene ist, wird gesagt, dass es sich in axialer Position befindet; Und wenn es parallel dazu ist, wird gesagt, dass es sich in äquatorialer Position befindet.
Reaktionen
Die Reaktionen, die Cycloalcan leiden kann. Beide verbrennen in Gegenwart eines überschüssigen Sauerstoffs in den typischen Verbrennungsreaktionen, um Kohlendioxid und Wasser zu erzeugen. Ebenso können beide Halogenierungen leiden, bei denen ein Wasserstoff durch ein Halogenatom ersetzt wird (F, Cl, Br, I).
Es kann Ihnen dienen: Vor- und Nachteile der Gesundheitschemie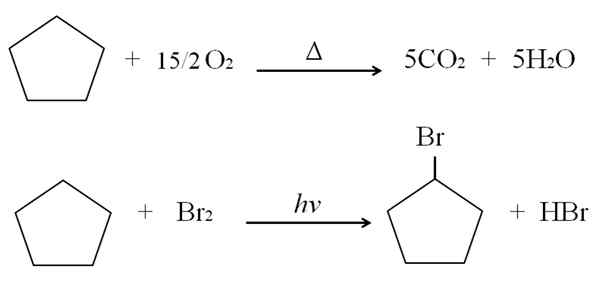 Cyclopentano -Reaktionen. Quelle: Gabriel Bolívar.
Cyclopentano -Reaktionen. Quelle: Gabriel Bolívar. Über den Verbrennungs- und Halogenierungsreaktionen für Cyclopentano wird als Beispiel dargestellt. Ein Maulwurf brennt in Gegenwart von Wärme und 7,5 Mol molekularer Sauerstoff, um in CO zu zerbrechen2 und h2ENTWEDER. Andererseits in Gegenwart von Ultraviolett und Brom.
Anwendungen
Die Verwendung von Cycloalcanos hängt weitgehend von ihrer Anzahl von Kohlenstoffen ab. Die leichtesten und damit gasförmigen, die einmal dazu dient, die Gaslampen öffentlicher Lichter zu füttern.
Flüssigkeiten haben inzwischen Gewinne als Lösungsmittel von Ölen, Fetten oder kommerziellen Produkten apolarer Natur. Unter diesen können Sie Cyclopentano, Cyclohexan und Cycloheptan erwähnen. Ebenso werden sie häufig in routinemäßigen Operationen in Petróleos -Labors oder in Kraftstoffformulierung verwendet.
Wenn sie schwerer sind, können sie als Schmiermittel verwendet werden. Andererseits können sie auch das Ausgangsmaterial für die Arzneimittelsynthese darstellen. Wie Carboplatin, das in seiner Struktur einen Cyclobutanring enthält.
Cychannel -Beispiele
Schließlich wird es zum Beginn des Artikels zurückgegeben: das Bild mit mehreren nicht erfüllten Cycloalcanos.
Um sich die Cycloalcanos zu merken.
Je größer der Ring ist, desto weniger ähnelt er seiner jeweiligen geometrischen Figur. Es wurde bereits gesehen, dass der Cyclohexan alles außer einem Sechseck ist; Gleiches geschieht offenbar mit dem Cyclootetredecano (vierzehn Kohlenstoffe).
Ein Punkt kommt, an dem sie sich wie Halsketten verhalten, die gefaltet werden können, um die Spannungen ihrer Glieder und Sonnenfinsternis in vollen Zügen zu verringern.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10. Ausgabe.). Wiley Plus.
- Chemistry Librettexts. (2. Juni 2019). Namenszykloalkane nennen. Erholt von: Chem.Librettexts.Org
- Wikipedia. (2019). Cycloalkane. Abgerufen von: in.Wikipedia.Org
- Clark Jim. (2015). Einführung von Alkaes und Cycloalkanen. Erholt von: Chemguide.CO.Vereinigtes Königreich
- James Ashenhurst. (2019). Konformationen und Cycloalkane. Meister organische Chemie. Erholt von: Masterorganicchemistry.com
- Fernández Germán. (S.F.). Cycloalcanos-Toria. Organische Chemie. Erholt von: Chemicicaorganica.Org

