Cyclobutanstruktur, Eigenschaften, Verwendung und Synthese
- 1590
- 269
- Frederike Birkemeyer
Er Cyclobutan Es ist ein Kohlenwasserstoff, der aus einem Vier -Zarbon4H8. Sie können auch Tetramethylen genannt werden, wenn man bedenkt, dass es vier UN -Einheiten gibt2 Das macht einen Ring mit quadratischer Geometrie aus, obwohl der Cyclobutan -Name akzeptierter und bekannt ist.
Bei Raumtemperatur ist es ein farbloses, brennbares Gas, das mit einer hellen Flamme brennt. Die primitivste Verwendung ist als Wärmequelle durch Verbrennen; Die strukturelle Basis (das Quadrat) umfasst jedoch tiefe biologische und chemische Aspekte und arbeitet auf eine bestimmte Weise mit den Eigenschaften dieser Verbindungen zusammen.
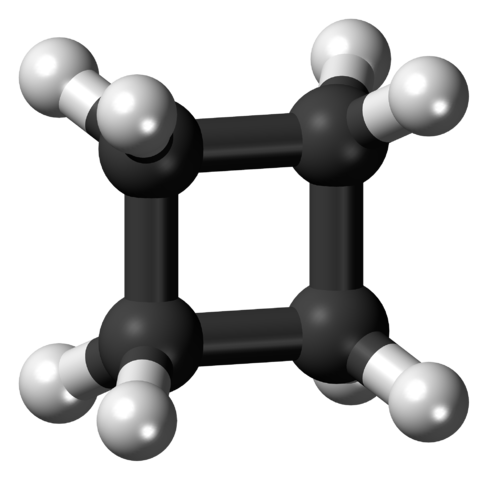 Cyclobutanmolekül in angespannter Konformation. Quelle: Jynto [CC0].
Cyclobutanmolekül in angespannter Konformation. Quelle: Jynto [CC0]. Im oberen Bild wird ein Cyclobutanmolekül mit quadratischer Struktur gezeigt. Im nächsten Abschnitt wird erklärt, warum diese Konformation instabil ist, da seine Links angespannt sind.
Nach Cyclopropo ist es der instabilste Cycloalcan, da je kleiner die Größe des Rings ist, desto reaktiver wird es. Danach ist das Cyclobutan instabiler als die Pentan- und Hexano -Zyklen. Es ist jedoch merkwürdig, in seinen Derivaten ein Kern- oder quadratisches Herz zu beobachten, was, wie er gesehen wird, dynamisch ist.
[TOC]
Cyclobutanstruktur
Im ersten Bild wurde die Struktur des Cyclobutan als einfacher Kohlenstoff und hydriertes Quadrat angesprochen. In diesem perfekten Quadrat erleiden die Orbitale jedoch eine schwere Verstauchung ihrer ursprünglichen Winkel3 (Winkelspannung).
Flecken des Kohlenstoffs3 Sie sind Tetraedralen, und für einige Tetraeder wäre es schwierig, beide Orbitale zu biegen, um einen Winkel von 90 ° zu erzeugen. Aber es wäre noch mehr für Kohlenstoffe mit SP -Hybridisierungen2 (120º) und SP (180º) leiten Ihre ursprünglichen Winkel ab. Aus diesem Grund hat das Cyclobutan SP -Kohlenstoffatome3 im Wesentlichen.
Kann Ihnen dienen: sekundärer Alkohol: Was ist, Struktur, Eigenschaften, verwendetAußerdem sind Wasserstoffatome sehr nahe beieinander und im Raum in den Schatten gestellt. Dies führt zu einer Erhöhung des sterischen Hindernisse.
Daher machen Winkel- und Torsionspannungen (eingekapselt im Begriff "Ringspannung") diese Konformation unter normalen Bedingungen instabil.
Der Cyclobutan.
Schmetterlinge oder faltige Konformationen
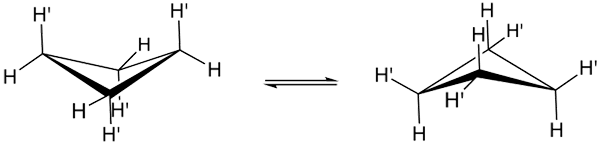 Cyclobutan -Konformationen. Quelle: Smokefoot.
Cyclobutan -Konformationen. Quelle: Smokefoot. Die wahren Konformationen des Cyclobutano sind oben gezeigt. In ihnen nehmen eckige und Torsionspannungen ab; Da, wie ersichtlich ist, sind nicht alle Wasserstoffatome in den Schatten gestellt. Es gibt jedoch Energiekosten: Der Winkel seiner Verbindungen wird verschärft, dh niedrig von 90 bis 88 °.
Beachten Sie, dass es mit einem Schmetterling verglichen werden kann, dessen dreieckige Flügel durch drei Kohlenstoffatome gebildet werden; und das vierte, positioniert in einem Winkel von 25º in Bezug auf jeden Flügel. Double Sense -Pfeile weisen darauf hin, dass zwischen beiden Konformeren ein Gleichgewicht besteht. Es ist, als ob der Schmetterling heruntergekommen ist und seine Flügel klettern.
In denjenigen, die vom Cyclobutan abgeleitet sind, wird andererseits erwartet, dass dieses Flattern viel langsamer und räumlich verhindert wird.
Intermolekulare Wechselwirkungen
Nehmen wir an, Sie vergessen für einige Momente der Quadrate und ersetzen Sie sie durch kohlensäurehaltige Schmetterlinge an Ort und Stelle. Sie befinden sich in ihrem Flattern können nur durch Londoner Dispersionskräfte in der Flüssigkeit zusammengehalten werden, die proportional zum Bereich ihrer Flügel und seiner molekularen Masse sind.
Es kann Ihnen dienen: Carbonylgruppe: Eigenschaften, Eigenschaften, Nomenklatur, ReaktivitätEigenschaften
Aussehen
Farbloses Gas.
Molekulare Masse
56,107 g/mol.
Siedepunkt
12,6ºC. Daher könnte es unter kalten Bedingungen im Prinzip als jede Flüssigkeit manipuliert werden; Mit dem einzigen Detail, dass es sehr flüchtig wäre und ihre Dämpfe immer noch ein Risiko darstellen, um dies zu berücksichtigen.
Schmelzpunkt
-91ºC.
Zündungspunkt
50 ° C eine geschlossene Tasse.
Löslichkeit
Unlöslich in Wasser, was angesichts seiner apolaren Natur nicht überrascht ist; Aber es ist etwas löslich in Alkoholen, Äther und Aceton, die weniger polare Lösungsmittel sind. Es wird erwartet, dass es logisch in apolaren Lösungsmitteln wie Kohlenstofftetrachlor, Benzol, Xylol usw. logisch logisch ist (obwohl nicht) löslich ist.
Dichte
0,7125 bis 5ºC (in Bezug auf 1 aus Wasser).
Wasserdampfdichte
1.93 (in Bezug auf 1 der Luft). Dies bedeutet, dass es dicht ist als die Luft, und daher, es sei denn, es gibt Strömungen, wird sein Trend nicht aufsteigen.
Dampfdruck
1.180 mmHg bei 25ºC.
Brechungsindex
1.3625 bis 290ºC.
Verbrennung Enthalpie
-655,9 kJ/mol.
Formationswärme
6,6 kcal/mol a 25ºC.
Synthese
Das Cyclobutan wird durch Hydrierung des Cyclobutadiens synthetisiert, dessen Struktur fast gleich ist, mit dem einzigen Unterschied, dass es eine Doppelbindung hat; Und deshalb ist es noch reaktiver. Dies ist vielleicht der einfachste synthetische Weg, um ihn zu erhalten, oder zumindest nur für ihn und nicht zu einem Derivat.
Im Rohöl ist es unwahrscheinlich.
Eine andere Methode, um das Cyclobutan zu erhalten2= Ch2, die gemessen werden. Diese Reaktion ist photochemisch bevorzugt, aber nicht thermodynamisch:
Kann Ihnen dienen: Benchilo Benzoate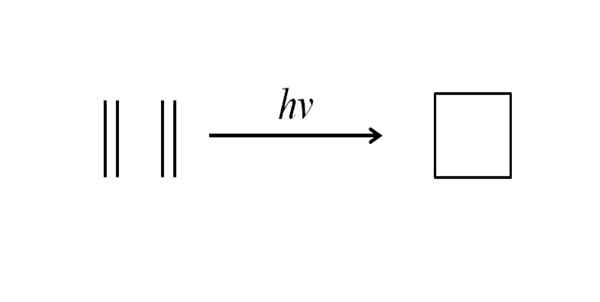 Cyclobutan -Synthese durch ultraviolette Strahlung. Quelle: Gabriel Bolívar.
Cyclobutan -Synthese durch ultraviolette Strahlung. Quelle: Gabriel Bolívar. Das obere Bild fasst das zusammen, was im Absatz oben gesagt wurde. Wenn es anstelle von Ethylen zum Beispiel zwei Alkene wäre, würde ein ersetzter Cyclobutan erhalten; oder was ist das gleiche, ein Cyclobutanderivat. Tatsächlich wurden viele Derivate mit interessanten Strukturen mit dieser Methode synthetisiert.
Andere Derivate implizieren jedoch eine Reihe komplizierter synthetischer Schritte. Daher sind Cyclobuta (wie ihre Derivate genannt) für die organische Synthese untersucht werden.
Anwendungen
Allein Cyclobutan hat nicht mehr verwendet, als als Wärmequelle zu dienen. Aber seine Derivate treten in komplizierte Länder in der organischen Synthese mit Anwendungen in Pharmakologie, Biotechnologie und Medizin ein. Ohne zu komplexe Strukturen zu vertiefen, sind Penitrems und Grandisol Beispiele für Cyclobutans.
Cyclobutaner haben im Allgemeinen Eigenschaften, die für die Metabolismen von Bakterien, Pflanzen, Wirbellosen für Meereswaren und Pilzen von Vorteil sind. Sie sind biologisch aktiv und deshalb sind ihre Verwendungen sehr unterschiedlich und schwer zu spezifizieren, da jeder ihre besonderen Auswirkungen auf bestimmte Organismen hat.
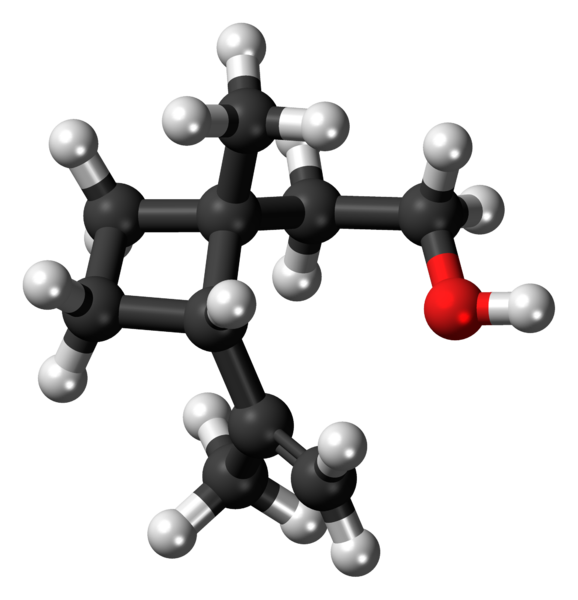
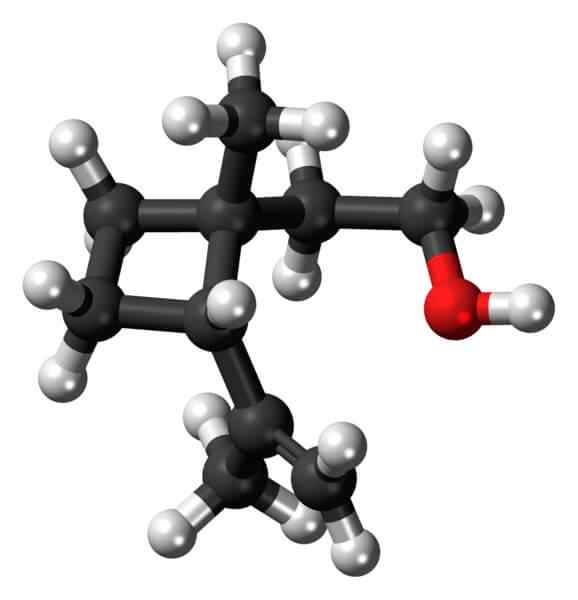 Grandisol: Ein Beispiel für ein Cyclobutanderivat. Quelle: Jynto [CC0].
Grandisol: Ein Beispiel für ein Cyclobutanderivat. Quelle: Jynto [CC0]. Grandisol zum Beispiel ist ein Gorgjo -Pheromon (eine Art Käfer). Oben und schließlich wird seine Struktur gezeigt, gilt als Monoterpen mit einer quadratischen Basis von Cyclobutan.
Verweise
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons, t.W.; Craig b. Braten. (2011). Organische Chemie. (elfth Auflage). Wiley.
- Wikipedia. (2019). Cyclobutan. Abgerufen von: in.Wikipedia.Org
- Pubchem. (2019). Cyclobutan. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Peiris Nicole. (29. November 2015). Physikalische Eigenschaften von Cycloalkanen. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Wiberg b. Kenneth. (2005). Cyclobutan-physikalische Eigenschaften und theoretische Studien. Abteilung für Chemie, Universität Yale.
- Klement Foo. (S.F.). Cyclobutane in der organischen Synthese. Abgerufen von: Scripps.Edu
- Myers. (S.F.). Cyclobutane -Synthese. Chem 115. Erholt von: hwpi.Harvard.Edu
- « Silberbromuro (AGBR) -Struktur, Eigenschaften und Verwendung
- Synthetische Arzneimitteleigenschaften, Typen und Wirkungen »

