Glutaminsäureeigenschaften, Funktionen, Biosynthese

- 3109
- 298
- Joe Hartwig
Er Glutaminsäure Es ist eine der 22 Aminosäuren, die die Proteine aller Lebewesen und eine der am häufigsten vorkommenden Natur ausmachen. Da der menschliche Körper intrinsische Routen für die Biosynthese hat, wird dies nicht als wesentlich angesehen.
Zusammen mit Asparaginsäure gehört Glutaminsäure zu der negativ belasteten polaren Aminosäuregruppe und wird nach den beiden vorhandenen Nomenklatursystemen (drei oder ein Buchstaben) als "als" als "bezeichnet" bezeichnetGlu"oder wie"UND".
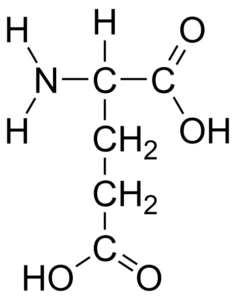 Glutaminsäure -Aminosäurestruktur (Quelle: HBF878 [CC0] über Wikimedia Commons)
Glutaminsäure -Aminosäurestruktur (Quelle: HBF878 [CC0] über Wikimedia Commons) Diese Aminosäure wurde 1866 vom deutschen Chemiker Rittershaus entdeckt, als er Weizengluten hydrolysiert hat, daher seine "glutamische" Konfession. Nach seiner Entdeckung wurde seine Anwesenheit in weiten Teilen von Lebewesen bestimmt, so.
L-Glutaminsäure gilt als einer der wichtigsten Mediatoren bei der Übertragung von exzitatorischen Signalen im Zentralnervensystem von Wirbeltieren und ist auch für die normale Funktion des Gehirns sowie für die kognitive Entwicklung, das Gedächtnis und für die Gedächtnis und die Lernen.
Einige seiner Derivate haben außerdem wichtige Funktionen auf industrieller Ebene, insbesondere in Bezug auf kulinarische Zubereitungen, da es dazu beiträgt, den Geschmack von Mahlzeiten zu verbessern.
[TOC]
Eigenschaften
Obwohl Glutamat (die ionisierte Form der Glutaminsäure) keine wesentliche Aminosäure für den Menschen ist, hat sie wichtige Nährwertauswirkungen auf das Tierwachstum und es wurde vorgeschlagen, dass sie einen viel größeren Nährwert als der anderer nicht -Essential Aminosäuren aufweist.
Diese Aminosäure ist im Gehirn besonders im Gehirn vorhanden.
Da es viele Funktionen in exzitatorischen Synapsen hat und seine Funktionen, die auf bestimmte Rezeptoren wirken.
Die Stellen mit der höchsten Glutamatkonzentration sind Nervenklemmen, ihre Verteilung ist jedoch durch den Energiebedarf der Zellen im gesamten Körper konditioniert.
Abhängig von der Art der Zelle kann sie, wenn Glutaminsäure in sie eintritt.
Struktur
Glutaminsäure ist wie der Rest von Aminosäuren eine α-Aminosäure mit einem zentralen Kohlenstoffatom (das chiral ist), α Carbon, dem vier weitere Gruppen beitreten: eine Carboxylgruppe, eine Amino-Gruppe, eine Amino-Gruppe, a Wasserstoffatom und eine Ersatzgruppe (Seitenkette oder Gruppe R).
Gruppe R von Glutaminsäure verleiht dem Molekül eine zweite Carboxylgruppe (-coh) und seine Struktur ist -Ch2-ch2-cooh (-Ch2-ch2-coo- in seiner ionisierten Form), so dass die Summe der Atome insgesamt Kohlenstoff des Moleküls ist fünf.
Diese Aminosäure hat eine relative Masse von 147 g/mol und die Dissoziationskonstante (PKA) ihrer Gruppe R 4 beträgt 4.25. Hat einen isoelektrischen Punkt von 3.22 und der durchschnittliche Proteinpräsenzindex liegt bei etwa 7%.
Da ein neutraler pH -Wert (um 7), Glutaminsäure ionisiert und eine negative Belastung aufweist, in der negativ belasteten polaren Aminosäuregruppe klassifiziert wird, in der auch Asparaginsäure einbezogen wird (Aspartat, in seiner ionisierten Form).
Funktionen
Glutaminsäure oder ihre ionisierte Form, Glutamat, hat mehrere Funktionen, nicht nur aus physiologischer Sicht, sondern auch aus industrieller, klinischer und gastronomischer Sicht.
Kann Ihnen dienen: Alpha -Liponsäure: Funktion, Eigenschaften, Vorteile, KontraindikationenPhysiologische Funktionen von Glutaminsäure
Eine der beliebtesten physiologischen Funktionen von Glutaminsäure im Körper der meisten Wirbeltiere ist ihre Teilnahme als Erreger -Neurotransmitter im Gehirn. Es wurde festgestellt, dass mehr als 80% der exzitatorischen Synapsen mit Glutamat oder einem seiner Derivate kommunizieren.
Zu den Funktionen, die die Synapsen, die diese Aminosäure verwenden, während der Signalübertragung haben.
Glutamat hängt auch mit der Entwicklung des Nervensystems, der Einleitung und Beseitigung von Synapsen und Migration, Differenzierung und Zelltod zusammen. Es ist wichtig für die Kommunikation zwischen peripheren Organen wie Lebensmittelgebieten, Bauchspeicheldrüse und Knochen.
Darüber hinaus hat Glutamat sowohl in den Prozessen der Protein- als auch in der Peptidsynthese und in der Synthese von Fettsäuren in der Regulation der Zellstickstoffspiegel und in der Kontrolle des anionischen und osmotischen Gleichgewichts Funktionen.
Es dient als Vorläufer für verschiedene Vermittler des Tricarbonsäurezyklus (Krebszyklus) und auch anderer Neurotransmitter wie GABA (aminobtyrische Gammasäure). Im Gegenzug ist es ein Vorläufer in der Synthese anderer Aminosäuren wie L-Prolin, L-Arginin und L-Alanina.
Klinische Anwendungen
Verschiedene pharmazeutische Ansätze basieren hauptsächlich auf Glutaminsäure -Rezeptoren wie therapeutischen Zielen für die Behandlung von psychiatrischen Erkrankungen und anderen mit dem Gedächtnis verbundenen Pathologien.
Glutamat wurde auch als aktives Wirkstoff in verschiedenen pharmakologischen Formulierungen zur Behandlung von Myokardinfarkten und funktionellen Dyspepsie verwendet (Magen- oder Verdauungsstörungsprobleme).
Industrielle Glutaminsäureanwendungen
Glutaminsäure und ihre Derivate haben verschiedene Anwendungen in verschiedenen Branchen. Zum Beispiel wird das monosodische Glutamatsalz in der Lebensmittelindustrie als Gewürz verwendet.
Diese Aminosäure ist auch das Ausgangsmaterial für die Synthese anderer Chemikalien und glutamisches Polycid ist ein biologisch abbaubares, essbares und nicht -toxisches natürliches anionisches Polymer für Menschen oder für die Umwelt.
In der Lebensmittelindustrie wird es auch als Verdicker und als „Relief“ -Intreich für die Bitterkeit verschiedener Lebensmittel verwendet.
Es wird auch als Kryoprotektor, als "heilbarer" biologischer Klebstoff als Arzneimitteltransporter für das Design biologisch abbaubarer Fasern und Hydrogele verwendet, die unter anderem große Mengen an Wasser absorbieren können.
Biosynthese
Alle Aminosäuren stammen aus glykolytischen Vermittlern, aus dem Krebszyklus oder dem Pentosephosphatweg. Glutamat ist speziell.
Der Biosyntheseweg dieser Aminosäure ist recht einfach und ihre Schritte sind in fast allen lebenden Organismen.
Glutamat- und Stickstoffstoffwechsel
Im Stickstoffstoffwechsel wird Ammonium durch Glutamat und Glutamin in die verschiedenen Biomoleküle des Körpers eingebaut, und durch Transaminierungsreaktionen liefert Glutamat die Aminogruppen der meisten Aminosäuren.
Somit impliziert dieser Weg die Assimilation von Ammoniumionen zu Glutamatmolekülen, die in zwei Reaktionen stattfinden.
Der erste Schritt der Route wird durch ein als Synthetase -Glutamin bekanntes Enzym katalysiert, das in praktisch allen Organismen vorhanden ist und an der Verringerung von Glutamat und Ammonium zur Herstellung von Glutamin beteiligt ist.
In Bakterien und Pflanzen wird hingegen Glutamat aus Glutamin durch Enzym, das als Synthase -Glutamat bekannt ist.
Bei Tieren wird dies aus der Transaminierung von α-Zetoglutarat erzeugt, die während des Aminosäurerkatabolismus stattfindet. Seine Hauptfunktion bei Säugetieren ist es, toxisches freies Ammonium in Glutamin umzuwandeln, das durch Blut transportiert wird.
Es kann Ihnen dienen: Embryologie: Geschichte, Studienbereich und ZweigeIn der durch die Enzym Glutamatsynthase katalysierten Reaktion durchläuft das α-Ketoglutarat einen reduzierenden Aminierungsprozess, bei dem Glutamin als Spender der Stickstoffgruppe teilnimmt.
Obwohl es in viel weniger proportional auftritt, wird bei Tieren das Glutamat auch durch die Reaktion eines einzelnen Schritt.
Dieses Enzym ist mit der Mitochondrienmatrix und der Reaktion, die Katalysen mehr oder weniger wie folgt geschrieben werden kann, assoziiert, wo NADPH in der Versorgung mit Reduzierung der Leistung arbeitet:
α-Ketoglutarat + NH4 + NADPH → L-Glutamat + NADP ( +) + Wasser
Stoffwechsel und Verschlechterung
Glutaminsäure wird von Körperzellen verwendet, um unterschiedlichen Zwecken zu dienen, unter denen die Proteinsynthese, der Energiestoffwechsel, die Ammoniumfixierung oder die Neurotransmission herausragend abfällt.
Das Glutamat, das aus dem extrazellulären Medium in einigen Arten von Nervenzellen entnommen wurde Glutaminglutamat.
Sobald die Darmabsorption von Glutaminsäure mit Diätfutter aufgenommen wurde, endet im Allgemeinen in ihrer Umwandlung in andere Aminosäuren wie Alanin, ein Prozess, das durch die Zellen der Darmschleimhaut vermittelt wird und sie auch als Energiequelle nutzen.
Die Leber hingegen ist dafür verantwortlich, Glukose und Laktat zu werden, von denen die chemische Energie haupt.
Es wurde berichtet.
Lebensmittel, die reich an Glutaminsäure sind
Glutaminsäure ist in den meisten von Menschen konsumierten Lebensmitteln vorhanden, und einige Autoren behaupten, dass für einen 70 kg Menschen die tägliche Einnahme von Glutaminsäure aus der Ernährung etwa 28 g beträgt.
Zu den reichsten Lebensmitteln in dieser Aminosäure gehören tierische Herkunft, wo das Fleisch (Rinder, Schwein, Schafe usw.), Eier, Milchprodukte und Fisch. Die in Glutamat reichhaltigen Lebensmittel der Pflanzen sind Samen, Getreide, Spargel und andere.
Zusätzlich zu den verschiedenen Arten von Lebensmitteln, die von Natur aus in dieser Aminosäure, als Derivat davon, das monosodische Glutamatsalz als Additiv verwendet werden.
Vorteile Ihrer Aufnahme
Glutamat zu verschiedenen kulinarischen Zubereitungen, die dazu beitragen, das Geschmacksgefühl in der Mundhöhle zu "induzieren", die anscheinend wichtige physiologische und ernährungsphysiologische Bedeutungen aufweist.
Klinische Studien haben gezeigt, dass die Glutaminsäureaufnahme potenzielle Anwendungen bei der Behandlung von „Störungen“ oder oralen Pathologien im Zusammenhang mit Geschmack und „Hyposalivation“ (Low -Speichel -Produktion) aufweist).
Ebenso ist Glutaminsäure (Glutamat) ein Nährstoff von großer Bedeutung für die Aufrechterhaltung der normalen Zellaktivität in der Darmschleimhaut.
Es wurde gezeigt, dass die Versorgung dieser Aminosäure an Ratten, die chemotherapeutischen Behandlungen durchlaufen haben.
In Japan dagegen wurden medizinische Diäten auf der Grundlage von Lebensmitteln entwickelt, die reich an Glutaminsäure für Patienten unterzogen werden.
Kann Ihnen dienen: Troponin: Eigenschaften, Struktur, Funktionen und TestsDiese Aminosäure wird auch verwendet, um Appetit bei älteren Patienten mit chronischer Gastritis zu induzieren, die normalerweise unangemessen sind.
Schließlich legen Studien, die sich auf die orale Versorgung von Glutaminsäure und Arginin beziehen.
Mangelerkrankungen
Da Glutaminsäure als Vorläufer bei der Synthese verschiedener Arten von Molekülen wie Aminosäuren und anderen Neurotransmitter dient, können genetische Defekte, die mit der Expression von Enzymen im Zusammenhang mit ihrer Biosynthese und Recycling verbunden sind.
Zum Beispiel ist das Discarboxylase -Glutaminsäure -Enzym für die Umwandlung von Glutamat in aminobutrische Gammasäure (GABA), einen essentiellen Neurotransmitter für Hemmnervreaktionen, verantwortlich.
Daher ist das Gleichgewicht zwischen Glutaminsäure und GABA von größter Bedeutung für die Aufrechterhaltung der kortikalen Erregbarkeitskontrolle, da Glutamat hauptsächlich in exzitativen Nervensynapsen wirkt.
Da Glutamat wiederum an einer Reihe von Gehirnfunktionen wie Lernen und Gedächtnis beteiligt ist, kann sein Mangel in diesen Klassen von kognitiven Prozessen Defekte verursachen, die es als Neurotransmitter erfordern.
Verweise
- Ariyoshi, m., Katane, m., Hamese, k., Miyoshi, und., Nakane, m., Hoshino, a.,… Matoba, s. (2017). D -Glutamat wird im Herzen Mithochondrien metabolisiert. Wissenschaftliche Berichte, 7(August 2016), 1-9. https: // doi.org/10.1038/SREP43911
- Barret, g. (1985). Chemie und Biochemie der Aminosäure. New York: Chapman und Hall.
- Danbolt, n. C. (2001). Glutamataufnahme. Fortschritte in der Neurobiologie, 65, 1-105.
- Fonnum, f. (1984). Glutamat: Ein Neurotransmitter im Gehirn des Säugetiers. Journal of Neurochemistry, 18(1), 27-33.
- Gratini, s. (2000). Internationales Symposium über Glutamat. Glutaminsäure, zwanzig Jahre später.
- Graham, t. UND., Sgro, v., Friars, d., & Gibala, m. J. (2000). Einnahme von Glutamat: Plasma und muskelfreie Aminosäurepools des ruhenden Menschen. American Journal of Physiology-Endocrinology und Stoffwechsel, 278, 83-89.
- Hu, c. J., Jiang, q. UND., Zhang, t., Yin, und. L., Li, f. N., Dein, j. UND.,... Kong, x. F. (2017). Nahrungsergänzung mit Arginin und Glutaminsäure verstärkt die wichtige lipogene Genexpression bei wachsenden Schweinen. Journal of Animal Science, 95(12), 5507-5515.
- Johnson, j. L. (1972). Glutaminsäure als synaptischer Sender im Nervensystem. Eine Rezension. Gehirnforschung, 37, 1-19.
- Kumar, r., Vikramachakravarthi, d., & Pal, p. (2014). Produktion und Reinigung von Glutaminsäure: Eine kritische Überprüfung zur Prozessintensivung. Chemieingenieurwesen und Verarbeitung: Prozessintensivierung, 81, 59-71.
- Mourtzakis, m., & Graham, t. UND. (2002). Glutamataufnahme und seine Auswirkungen in Ruhe und beim Training beim Menschen. Journal of Applied Physiology, 93(4), 1251-1259.
- Neil, e. (2010). Biologische Prozesse für die Wasserstoffproduktion. Fortschritte in der biochemischen Technik/Biotechnologie, 123(Juli 2015), 127-141. https: // doi.org/10.1007/10
- Okumoto, s., Funck, d., Trovato, m., & Forlani, G. (2016). Aminosäuren der Glutamatfamilie: Funktionen jenseits des primären Stoffwechsels. Grenzen in der Pflanzenwissenschaft, 7, 1-3.
- Olubodun, j. ENTWEDER., Zulkifli, ich., Farjam, a. S., Haarbejo, m., & Kasim, a. (2015). Gutamin- und Glutaminsäure -Supplementierung verbessert die Leistung von Broiler -Hühnern unter dem heißen und feuchten tropischen Zustand. Italienisches Journal of Animal Science, 14(1), 25-29.
- Umbarger, h. (1978). Aminosäure -Biosynthese und ihre Regulierung. Ann. Rev. Biochem., 47, 533-606.
- Waelsch, h. (1951). Glutaminsäure und Gehirnfunktion. Fortschritte in der Proteinchemie, 6, 299-341.
- Yelamanchi, s. D., Jayaram, s., Thomas, j. K., Gundimeda, s., Khan, a. ZU., Singhal, a.,... Gowda, h. (2015). Eine Wegkarte des Glutamat -Stoffwechsels. Zeitschrift für Zellkommunikation und Signalübertragung, 10(1), 69-75.
- « Alanina -Eigenschaften, Struktur, Funktionen, Biosynthese
- Sparagineigenschaften, Struktur, Funktionen, Biosynthese »

