Sparagineigenschaften, Struktur, Funktionen, Biosynthese
- 4066
- 983
- Jasmine Kupprion
Der Spargel (ASN oder N) ist eine wichtige Aminosäure für die Zellsignale und die Vereinigung zwischen Proteinen und Kohlenhydraten. Dies ist eine der 22 grundlegenden Aminosäuren und wird als nicht wesentlich katalogisiert, da sie vom Körper von Säugetieren synthetisiert wird.
Diese Aminosäure wird innerhalb der Gruppe der polaren Aminosäuren ohne Last klassifiziert und war die erste nackte Aminosäure, eine Tatsache, die 1806 auftrat, wo sie aus dem Spargelsaft (eine Art krautige Pflanze) von den französischen Chemikalien Vauquelin und von der französischen Chemikalien isoliert wurde Robiquet.
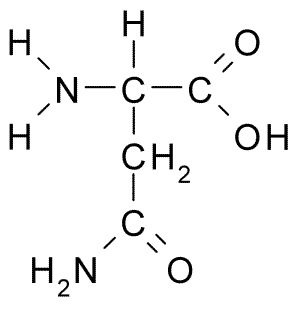
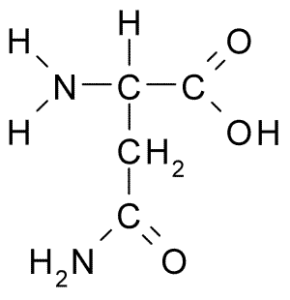 Chemische Struktur von Aminosäuresparagin (Quelle: Borb über Wikimedia Commons)
Chemische Struktur von Aminosäuresparagin (Quelle: Borb über Wikimedia Commons) Trotz seiner frühen Entdeckung wurde die biologische und ernährungsphysiologische Rolle von Asparagin nicht erkannt, sondern mehr als 100 Jahre später, als 1932 seine Anwesenheit in der Struktur eines in den Hanfsamen vorhandenen Proteins bestätigt wurde.
Asparagin und Glutamin dienen als Substrate für die inmitten Gruppen von zwei sehr häufigen Aminosäuren in Proteinen: Aspartic (Asparysäure) bzw. Glutamat (Glutaminsäure). Asparagin und Glutamin lassen sich in diesen Aminosäuren durch enzymatische Wirkung oder Säure- und Basisverbindungen leicht hydrolysiert.
Viele Protease -Serinenzyme, die für hydrolyse Peptidbindungen verantwortlich sind. Dieser Rückstand hat eine negative teilweise Belastung und ist verantwortlich für die Verbindung mit der positiven Belastung der weißen Peptide und der Annäherung an die Schneidstelle.
Das Verantwortliche der Oxalacetat-Synthese aus Asparagin wird in chemotherapeutischen Behandlungen verwendet und ist als L-Asparaginase bekannt, das für die Katalyse der hydrolytischen Fragmentierung der Amida von Asparagin zu Aspartat und Ammonium verantwortlich ist.
Asparaginase ist über exprimiert und gereinigt von Escherichia coli, Bei Kindern von Kindern mit akuter lymphoblastischer Leukämie injiziert werden, da sowohl normale als auch maligne Lymphozyten von der Einnahme von Sparagin im Blut für Wachstum und Multiplikation abhängen.
[TOC]
Eigenschaften und Struktur
Alle chemischen Strukturen der Aminosäuren haben eine Carboxylgruppe (-coh), eine Amino-Gruppe (-nh3+), einen Wasserstoff (-H) und eine R- oder Substituentengruppe, die durch das gleiche zentrale Kohlenstoffatom, das als Kohlenstoff bekannt ist, vereint ist α.
Aminosäuren unterscheiden.
Kohlenstoffatome von R -Gruppen identifizieren sich mit Buchstaben aus dem griechischen Alphabet. Daher werden im Fall von Asparagin die Kohlenstoffe der R -Kette als β- und γ -Kohlenstoffe identifiziert.
Kann Ihnen dienen: Agar XLD: Foundation, Vorbereitung und VerwendungNach einer anderen Art von Nomenklaturen wird das Kohlenstoffatom in der Carboxylgruppe (-coh) als C-1 aufgeführt. Daher würde der Kohlenstoff α C-2 fortsetzen, und so weiter.
Ein Asparaginmolekül verfügt über vier Kohlenstoffatome, darunter Kohlenstoff-α, Carboxylgruppenkohlenstoff und zwei Kohlenstoffatome, die Teil der R-Gruppe sind, die als Carboxamid bekannt ist (-Ch2-Co-Co-CO-NH2).
Diese Carboxamidgruppe ist nur in zwei Aminosäuren vorhanden: in Asparagin und Glutamin. Es hat das Merkmal, dass es durch die Amino-Gruppe (-nh2) und die Carbonylgruppe (-co) mit hoher Leichtigkeit Wasserstoffbrücken bilden kann.
Einstufung
Sparagin gehört zur Gruppe polarer Aminosäuren ohne Last, die sehr lösliche Aminosäuren in Wasser und sehr hydrophil sind (aufgrund ihrer Bildungskapazität mehrerer Wasserstoffbrücken).
In der Gruppe der polaren Aminosäuren ohne Last sind auch Serin, Treonin, Cystein und Glutamin. All dies sind Verbindungen "ZwitterionikDa sie eine polare Gruppe in ihrer R -Kette haben, die zur Neutralisation der Lasten beiträgt.
Alle polaren Aminosäuren ohne Last sind in den pH -Wert nahe 7 (neutral) nicht ionisierbar. Sie haben keine positiven oder negativen Ladungen. In sauren und basischen Medien werden Substituenten jedoch ionisiert und erwerben eine Belastung.
Stereochemie
Der zentrale Kohlenstoff- oder α -Kohlenstoff der Aminosäuren ist ein chiraler Kohlenstoff. Er hat also vier verschiedene vereinte Substituenten, was mindestens zwei unterscheidbare Stereoisomere für jede Aminosäure verursacht.
Stereoisomere sind Spiegelbilder eines Moleküls mit derselben molekularen Formel, aber nicht überpolkbar miteinander, wie z. B. Hände (links und rechts). Sie werden mit dem Buchstaben D oder L bezeichnet, da experimentell die Lösungen dieser Aminosäuren die polarisierte Lichtebene in entgegengesetzte Richtungen drehen.
Die allgemeine Asymmetrie von Aminosäuren macht die Stereochemie dieser Verbindungen von großer Bedeutung, da jeder unterschiedliche Eigenschaften hat, synthetisiert wird und an verschiedenen Stoffwechselstrecken beteiligt ist.
Sparagin ist in der Form von D-Asparagin oder L-Asparagin vorhanden, wobei letztere der häufigste in der Natur ist. Es wird durch L-Synthesase synthetisiert und für L-Asparaginase metabolisiert. Beide Enzyme sind in der Wirbeltierleber sehr reichlich vorhanden.
Funktionen
Die Leichtigkeit der Bildung von Asparagin -Wasserstoffbrücken macht es zu einer entscheidenden Aminosäure für die strukturelle Stabilität von Proteinen, da sie mit den lateralen Ketten der anderen Aminosäuren, die sie ausmachen, innere Wasserstoffbrücken bilden kann.
Kann Ihnen dienen: 25 Beispiele für asexuelle ReproduktionSparagin findet sich normalerweise auf der Oberfläche typischer wässriger Medien und stabilisiert ihre Struktur.
Viele Glykoproteine können durch einen Sparagin-, Treonin- oder Serinrest an Kohlenhydrate oder Kohlenhydrate binden. Im Falle von Asparagin wird ein Acetyl-Galactosamin im Allgemeinen durch N-Glycycosylierung der Amino-Gruppe verbunden.
Es ist wichtig zu hervorheben, dass in allen n-glykosylierten Glykoproteinen Kohlenhydrate durch einen Sparaginrest, der sich in einer bestimmten Region befindet.
Diese Glykoproteine werden im endoplasmatischen Retikulum zusammengesetzt, wo sie glykosyliert sind, wenn sie übersetzt werden.
Biosynthese
Alle eukaryotischen Organismen assimilieren Ammoniak und verwandeln es in Glutamat, Glutamin, Carbamil-Phosphat und Spargin. Asparagin kann aus glykolytischen Vermittlern, im Zitronensäurzyklus (aus Oxalacetat) oder aus den in der Ernährung konsumierten Vorläufer synthetisiert werden.
Das Synthetase -Asparagin -Enzym ist ein Amidotransferase, das von Glutamin und ATP abhängig ist, dass das ATP und die anorganische Pyrophosphat (PPI) das Ammoniak oder Glutamin spuckt und verwendet.
Sowohl Bakterien als auch Tiere haben ein Synthetase -Asparagin. In Bakterien verwendet das Enzym jedoch das Ammoniumion als Stickstoffspender, während bei Säugetieren die Synthetica -Synthese Gutamin als Hauptspender der Nitrogengruppe verwendet.
Der enzymatische Bruch des ATP zu Amp und anorganischen Pyrophosphat (PPI) sowie Glutamin als Spender der Amida-Gruppe sind die Hauptunterschiede in Bezug auf die Biosynthese von L-Glutamin zwischen den verschiedenen Organismen.
Degradierung
Die meisten Studien zum Asparaginstoffwechsel wurden in Pflanzen durchgeführt, angesichts der Tatsache, dass anfänglich Studien an Säugetieren durch den Mangel an Methoden behindert wurden.
L-Asparagin wird durch L-Asparaginase in Säugetieren ständig hydrolysiert, um Asparaginsäure und Ammonium zu verursachen. Es wird zur Synthese von Glykoproteinen verwendet und ist einer der Hauptvorläufer von Oxalacetat für den Zitronensäurezyklus.
Asparaginase-Enzymkatalysierung der Asparaginhydrolyse zu Aspartat, anschließend Aspartat.
Kann Ihnen dienen: EpiblastSyntheta-Asparagin, auch als Aspartat-Amoniaco-Ligase bekannt, ist reich an Gehirnzellen von Säugetieren.
Wenn niedrige Spiegel dieses Enzyms im Körper wahrgenommen werden, wird das, was als "Aminoacidopathies" bezeichnet wird.
Lebensmittel, die reich an Sparagin sind
Menschen mit akuter lymphoblastischer Leukämie haben normalerweise Mängel in Bezug auf das Synthetase -Asparagin -Enzym und sind im Umlauf von Sparagin abhängig. Daher wird ihnen eine Diät in Lebensmitteln empfohlen.
Unter den mehreren Lebensmitteln mit einem hohen Sparagingehalt befinden sich sie.
Es gibt L-Asparagin-Konzentrate, die für Hochwettbewerbsportler formuliert sind, da ihr Verbrauch dazu beiträgt, die Proteine zu regenerieren, aus denen das Gewebe besteht.
Darüber hinaus nehmen Menschen, die die Aminosäuresynthese einstellen, diese Tabletten auch auf, um Störungen in ihrem Zentralnervensystem zu vermeiden.
Asparagin ist leichter zu metabolisieren durch seine L-Asparaginform, da viele der an ihrem Stoffwechsel beteiligten Enzyme die D-Asparagin-Form nicht erkennen und daher nicht alle in Lebensmitteln aufgenommenen Sparagin für verschiedene Organismusprozesse verfügbar sind.
Die reichlich vorhandene Asparaginaufnahme kann von Vorteil sein, es wird jedoch nicht empfohlen, nicht.
Verweise
- Cooney, d. ZU., Capizzi, r. L., & Handschumacher, r. UND. (1970). Bewertung des L-Asparagin-Stoffwechsels in Anims und Mann. Krebsforschung, 30 (4), 929-935
- Dunlop, p. C., Roon, r. J., & Sogar, h. L. (1976). Verwendung von D-Asparagin durch Saccharomyces cerevisiaee. Journal of Bacteriology, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & Marsolais, f. (2017). Fortschritte im Sparagin -Stoffwechsel. In Fortschritte in der Botanik Vol. 79 (pp. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, s. (1985). Zusammenstellung von Sparagin-verknüpften Oligosacchariden. Jährliche Überprüfung der Biochemie, 54 (1), 631-664
- Mathews, c. K., & Ahern, k. G. (2002). Biochemie. Pearson Ausbildung.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Yamada, k., Hashizume, d., Shimizu, t., & Yokoyama, s. (2007). L-Asparagine. Kristallographischer Akt Abschnitt E: Strukturberichte online, 63 (9), 3802-3803.

