Galvanische Korrosionsmechanismen, Beispiele, Schutz

- 4274
- 905
- Ibrahim Steuk
Der Galvanische oder elektrochemische Korrosion Es ist ein Verfahren, durch das eine Metall oder eine Legierung im Vergleich zu seiner konventionellen Oxidation schwacher verschlechtert wird. Es kann gesagt werden, dass es sich um eine beschleunigte Oxidation handelt und sogar absichtlich geführt wurde; wie in Batterien oder Batterien.
Dies findet unter einer Reihe von Bedingungen statt. Erstens muss es ein aktives Metall namens Anode geben. Auch und zweitens muss es ein kleines reaktives Edelmetall namens Cathode geben. Die dritte und vierte Bedingungen sind das Vorhandensein eines Medium.
 Oxidierte Eisenkrone. Quelle: Pixnio.
Oxidierte Eisenkrone. Quelle: Pixnio. Galvanische Korrosion ist insbesondere in Meeresumgebungen oder an den Banken der Strände zu beobachten. Luftströmungen heben Wasserdampfmassen an, die wiederum einige Ionen ziehen; Letzteres hält an einer dünnen Wasserschicht oder Tropfen, die auf der Metalloberfläche ruhen.
Diese Bedingungen der Luftfeuchtigkeit und des Salzgehalts bevorzugen Metallkorrosion. Das heißt.
Die Leichtigkeit, dass ein Metall im Vergleich zu einem anderen oxidieren muss, kann quantitativ durch seine Reduktionspotentiale gemessen werden. In den Chemiebüchern gibt es zahlreiche Tische mit diesen Potentialen und. Je negativer, desto größer ist Ihre Neigung zum Oxidieren.
Wenn sich dieses Metall in Gegenwart eines anderen mit einem sehr positiven Reduktionspotential befindet und daher ein großes ΔE aufweist, wird die Oxidation des reaktiven Metalls aggressiver sein. Andere Faktoren wie pH, ionische Kraft, Luftfeuchtigkeit, das Vorhandensein von Sauerstoff und die Beziehung zwischen den oxidierten Metallflächen sind ebenfalls wichtig.
[TOC]
Mechanismen
Konzepte und Reaktionen
Bevor Sie die Mechanismen hinter der galvanischen Korrosion ansprechen, müssen bestimmte Konzepte geklärt werden.
In einer Reaktion verliert eine Spezies Elektronen (oxidiert), während ein anderer sie gewinnt (sie wird reduziert). Die Elektrode, auf der Oxidation stattfindet, heißt Anode; Und auf welcher Reduktion der Kathode (in englischer Sprache die nemonische Regel verwendet wird Rote Katze erinnern).
So für eine Elektrode (ein Stück, Schraube usw.) Von einem Metall m, wenn dies oxidiert wird, wird gesagt, dass es die Anode ist:
M => mN+ + ne-
Die Anzahl der freigesetzten Elektronen entspricht der Größe der positiven Last von Kation mN+ resultierend.
Dann erhält eine andere Elektrode oder ein anderer Metall (beide Metalle müssen in irgendeiner Weise in Kontakt stehen) die freigesetzten Elektronen. Dies erleidet jedoch keine chemische Reaktion, wenn sie Elektronen gewinnen, da sie sie nur durchführen würde (elektrischer Strom).
Daher muss es eine andere Spezies in Lösung geben, die diese Elektronen formell akzeptieren können. So einfach zu reduzieren Metallionen, zum Beispiel:
Kann Ihnen dienen: inhomogenes SystemRN+ + ne- => R
Das heißt, eine Metallschicht würde sich bilden und die Elektrode würde schwerer werden; Während das Metall M die Masse verlieren würde, weil sich ihre Atome auflösen.
Depolarisatoren
Und wenn es keine Metallkationen gäbe, die ausreichend reduziert werden konnten? In diesem Fall werden andere in der Mitte vorhandene Arten Elektronen erfordern: Depolarizadores. Diese sind eng mit PH: O verwandt2, H+, Oh- und h2ENTWEDER.
Sauerstoff- und Wassergewinnelektronen in einer Reaktion, die durch die folgende chemische Gleichung ausgedrückt wird:
ENTWEDER2 + 2H2O + 4e- => 4OH-
Während Iones h+ Sie verwandeln sich in h2:
2H+ + 2e- => H2
Das heißt, oh Spezies- und h2 Sie sind häufige Produkte von galvanischen oder elektrochemischen Korrosionen.
Auch wenn Metal R nicht an einer Reaktion teilnimmt, fördert die Tatsache, edeler zu sein, dass M seine Oxidation fördert. Und folglich wird es eine größere Produktion von OH -Ionen geben- o Wasserstoffgas. Weil es schließlich der Unterschied zwischen Reduktionspotentialen ist, ΔE, einer der Hauptmotoren dieser Prozesse.
Eisenkorrosion
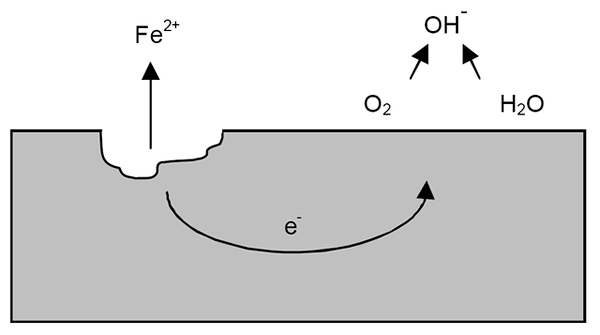 Korrosionsmechanismus für Eisen. Quelle: Wikipedia.
Korrosionsmechanismus für Eisen. Quelle: Wikipedia. Nach den vorherigen Klarstellungen kann das Beispiel für Eisenkorrosion (überlegenes Bild) angesprochen werden. Angenommen, es gibt eine dünne Wasserschicht, in der sich Sauerstoff auflöst. Ohne das Vorhandensein anderer Metalle sind es die Depolarizadoren, die die Reaktionsrichtlinien markieren.
Somit verliert Eisen einige Atome an seiner Oberfläche, um sich in Wasser als Glaubenskationen aufzulösen2+:
Fe => Glaube2+ + 2e-
Die beiden Elektronen fahren das Eisenstück, um ein guter Stromleiter zu sein. So dass es bekannt ist, wo die Oxidation oder eine anodische Stätte begann; Aber nicht dort, wo die Reduzierung oder der Ort des kathodischen Standorts fortgesetzt werden. Die kathodische Seite kann überall sein; Und je höher der mögliche Bereich, schlechter wird die Korrosion des Metalls.
Nehmen wir an, Elektronen erreichen einen Punkt, wie im oberen Bild gezeigt. Dort leiden sowohl Sauerstoff als auch Wasser die bereits beschriebene Reaktion, durch die OH freigesetzt wird-. Diese Anionen oh- Sie können mit Glauben reagieren2+ Glauben bilden (OH)2, was ausfällt und nach nachfolgenden Oxidationen leidet, die es schließlich in Rost verwandeln.
In der Zwischenzeit knackt die anodische Seite immer mehr.
Beispiele
Im täglichen Leben sind Beispiele für galvanische Korrosionen zahlreich. Wir müssen uns nicht auf die Eisenkrone beziehen.
Kann Ihnen dienen: PhosphatgruppeZusätzlich zum Strand kann der Winter auch die idealen Bedingungen für die Korrosion beitragen. Zum Beispiel, wenn Sie Salze auf den Straßenschnee werfen, um zu verhindern, dass Autos Skaten.
Aus physischer Sicht kann es in den geschweißten Gewerkschaften von zwei Metallen Feuchtigkeit beibehalten, da es aktive Korrosionsstellen ist. Dies liegt daran, dass beide Metalle sich wie zwei Elektroden verhalten und die reaktivsten ihre Elektronen verlieren.
Wenn oh Ion -Produktion- Es ist beträchtlich, Sie können sogar die Farbe des Autos oder des fraglichen Artefakts laufen lassen.
Anodische Indizes
Man kann ihre eigenen Beispiele für galvanische Korrosions mithilfe der Reduktionspotentabellen erstellen. Die anodische Indextabelle (von selbst vereinfacht) wird jedoch ausgewählt, um diesen Punkt zu veranschaulichen.
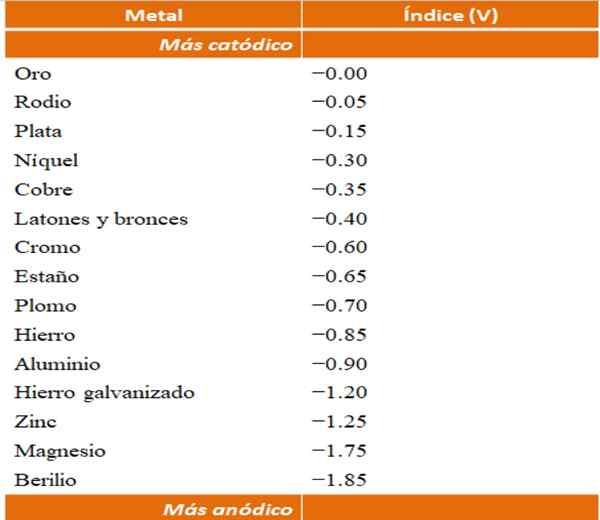 Anodische Indizes für verschiedene Metalle oder Legierungen. Quelle: Wikipedia.
Anodische Indizes für verschiedene Metalle oder Legierungen. Quelle: Wikipedia. Nehmen wir zum Beispiel an, dass wir eine elektrochemische Zelle bauen möchten. Die Metalle, die der obere Teil der anodischen Indizes Tabelle sind, sind mehr Kathoden; Das heißt, sie sind leicht zu reduzieren und es wird daher schwierig sein, sie in Lösung zu haben. Während Metalle, die unten sind.
Wenn wir uns für Gold und Beryllium entscheiden, könnten beide Metalle nicht lange nicht zusammen sein, da Beryllium mit extremem Schnellgrad oxidieren würde.
Und wenn wir im Gegenteil eine Ag -Ion -Lösung haben+ Und wir tauchen einen Aluminiumstab ein, er löst sich gleichzeitig auf. Wenn dieser Balken an eine Graphitelektrode hergestellt wird, reisen Elektronen dazu, um Silber wie einen Silberfilm elektrochemisch abzulegen.
Und wenn anstelle des Aluminiumstangens kein Kupfer mehr ist, würde die Lösung durch das Vorhandensein der Ionen Cu bläulich werden2+ im Wasser.
Schutz gegen elektrochemische Korrosion
Opferbeschichtungen
Angenommen, es soll in Gegenwart anderer Metalle eine Lamina der Korrosion schützen. Die einfachste Option wäre das Hinzufügen von Magnesium, das das Zink abdecken würde, so dass die aus Magnesium freigesetzten Elektronen nach oxidieren2+ zurück.
Mgos Film über Zink eher früher als später würde es knacken und einen hohen Standort mit hoher Dichte liefern. Das heißt, die Zinkkorrosion würde an diesen Punkten genau richtig beschleunigen.
Diese Technik des Schutzes gegen elektrochemische Korrosion ist als Verwendung von Opferverkleidungen bekannt. Das bekannteste ist Zink, das in der berühmten Technik namens Galvanization verwendet wird. In ihnen ist Metall M bedeckt, insbesondere Eisen, Zink (Faith/Zn).
Kann Ihnen dienen: Phenolphthalein (C20H14O4)Auch hier oxidiert Zink und sein Oxid dient dazu, Eisen abzudecken und Elektronen zu übertragen, die den Glauben reduzieren2+ das kann gebildet werden.
Edle Beschichtungen
Nehmen wir erneut an, dass Sie das gleiche Zinkblatt schützen möchten, aber jetzt wird Chrom anstelle von Magnesium verwendet. Chrom ist edeler (kathodischer, siehe die Tabelle der anodischen Indizes) als Zink, und deshalb wirkt es als edle Beschichtung.
Das Problem dieser Art der Beschichtung ist, dass sie die Oxidation des Metalls unten fördern und weiter beschleunigen wird. In diesem Fall ist Zink noch mehr korrodiert als mit Magnesium bedeckt zu werden.
Und schließlich gibt es andere Beschichtungen, die aus Gemälden, Kunststoffen, Antioxidantien, Fetten, Harzen usw. bestehen.
Kinderexperiment
Eisenplatte in Kupfersalz
Ein einfaches Experiment kann aus derselben Tabelle anodischer Indizes hergestellt werden. Auflösen eines angemessenen Betrags (weniger als 10 Gramm) Cuso4· 5h2Oder in Wasser wird ein Kind gebeten, auf eine polierte Eisenplatte einzutauchen. Ein Foto wird aufgenommen und der Prozess darf sich für ein paar Wochen entwickeln.
Die Auflösung ist zunächst bläulich, wird jedoch anfärben, während die Eisenplatte eine Kupferfarbe erwirbt. Dies liegt daran, dass Kupfer edel als Eisen ist und daher seine Kationen Cu2+ Sie werden von den Ionen auf metallisches Kupfer reduziert, die durch die Oxidation von Eisen zugewiesen wurden:
Fe => Glaube2+ + 2e-
Cu2+ + 2e- => Cu
Silberoxidreinigung
Silberobjekte schwärzen im Laufe der Zeit, insbesondere wenn sie mit einer Quelle von Schwefelverbindungen in Kontakt stehen. Sein Oxid kann entfernt werden, wenn das Objekt in eine Wasserwanne mit Natriumbicarbonat und Aluminiumfolie getaucht ist. Bicarbonat liefert Elektrolyte, die den Transport von Elektronen zwischen Objekt und Aluminium erleichtern.
Infolgedessen kann das Kind zu schätzen wissen, dass das Objekt seine schwarzen Flecken verliert und mit seiner charakteristischen silbernen Farbe glänzen wird. Während die Aluminiumfolie bis zum Verschwinden verläuft.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2019). Galvanische Korrosion. Abgerufen von: in.Wikipedia.Org
- Stephen Lower. (16. Juni 2019). Wahlochemische Korrosion. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Die offene Universität. (2018). 2.4 Korrosionsprozess: galvanische Korrosion. Erholt von: offen.Edu
- Customer Technical Service Pinsel Wellman Inc. (S.F.). Ein Leitfaden zur galvanischen Korrosion. Wellman -bürsten -konstruierte Materialien.
- Giorgio Carboni. (1998). Experimente in der Wahlochemie. Abgerufen von: fensci.com
- « Sophistische Relativismus Herkunft, Merkmale, Beispiele
- Zyklische Kohlenwasserstoffstruktur, Eigenschaften, Beispiele »

