Meniskus (Chemie)
- 3745
- 705
- René Riediger
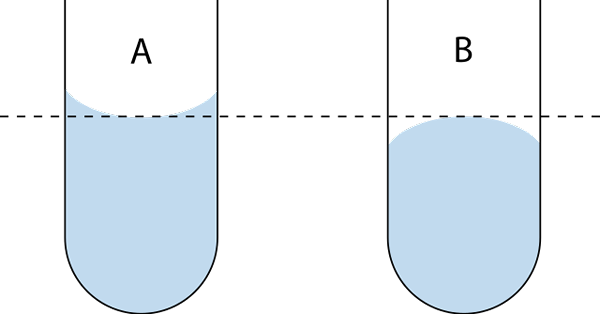
 Konkaver und konvexer Meniskus. Quelle: Wikimedia Commons
Konkaver und konvexer Meniskus. Quelle: Wikimedia Commons Was ist der Meniskus (Chemie)?
Er Meniskus Es ist die Krümmung der Oberfläche einer Flüssigkeit. Es ist auch die freie Oberfläche einer Flüssigkeit in der Flüssigkeits-Luft-Grenzfläche. Flüssigkeiten sind durch ein festes Volumen gekennzeichnet, das unkombes ist.
Die Form der Flüssigkeiten variiert jedoch mit der Form des sie enthält die Form des Behälters, der sie enthält. Diese Eigenschaft ist auf die zufällige Bewegung der Moleküle zurückzuführen, die sie bilden.
Flüssigkeiten haben die Fähigkeit zu fließen, hohe Dichte und sich schnell in anderen Flüssigkeiten auszubreiten, mit denen sie mischbar sind.
Sie belegen den niedrigsten Bereich des Behälters und hinterlassen eine freie nicht vollständig flache Oberfläche oben. Unter bestimmten Umständen können sie spezielle Formen wie Tropfen, Blasen und Blasen annehmen.
Die Eigenschaften von Flüssigkeiten wie dem Schmelzpunkt, des Dampfdrucks, der Viskosität und der Verdampfungswärme hängen von der Intensität der intermolekularen Kräfte ab, die Flüssigkeiten Kohäsion verleihen.
Flüssigkeiten interagieren jedoch auch mit dem Behälter durch Adhäsionskräfte.
Der Meniskus entsteht dann aus diesen physikalischen Phänomen.
Was ist der Meniskus?
Wie erklärt, ist der Meniskus das Ergebnis mehrerer physikalischer Phänomene, unter denen auch die Oberflächenspannung der Flüssigkeit erwähnt werden kann.
Kohäsionskräfte
Kohäsionskräfte sind der physikalische Begriff, der intermolekulare Wechselwirkungen innerhalb der Flüssigkeit erklärt. Bei Wasser sind Kohäsionskräfte auf die Dipol-Dipolo-Wechselwirkung und Wasserstoffbrücken zurückzuführen.
Kann Ihnen dienen: Chloroxid (III): Eigenschaften, Struktur, verwendetDas Wassermolekül ist die bipolare Natur. Dies liegt daran.
Es gibt eine elektrostatische Anziehungskraft zwischen der negativen Belastung eines Wassermoleküls in Sauerstoff und der positiven Belastung eines anderen Wassermoleküls in Hydrogenen.
Diese Wechselwirkung ist das, was er als Dipol-Dipol-Wechselwirkung oder -kraft kennt, was zum flüssigen Zusammenhalt beiträgt.
Adhäsionskräfte
Andererseits können Wassermoleküle mit Glaswänden durch teilweise Belastung der Wasserstoffatome der Wassermoleküle, die die Sauerstoffatome der Glasoberfläche des Glases in den Sauerstoffatomen binden, interagieren.
Dies bildet die Adhäsionskraft zwischen der Flüssigkeit und der starren Wand, was umgangssprachlich bedeutet.
Wenn eine Silikonlösung auf die Glasoberfläche platziert wird, imprägniert das Wasser das Glas nicht vollständig, sondern wird auf diesen Tropfen gebildet, die leicht beseitigt werden können.
Somit wird angezeigt, dass bei dieser Behandlung die Adhäsionskraft zwischen Wasser und Glas verringert wird.
Ein sehr ähnlicher Fall tritt auf, wenn die Hände ölig sind und wenn sie mit Wasser waschen, sind sehr definierte Tropfen auf der Haut anstelle der angefeuchteten Haut zu sehen.
Arten von Meniskus
Es gibt zwei Arten von Meniskus: das Konkave und das Konvex. Im überlegenen Bild ist das Konkav das A und das konvexe b. Die gepunkteten Linien geben beim Lesen eines Volumenmaßes die richtige Spülung an.
Kann Ihnen dienen: Neutrales AtomKonkaver Meniskus
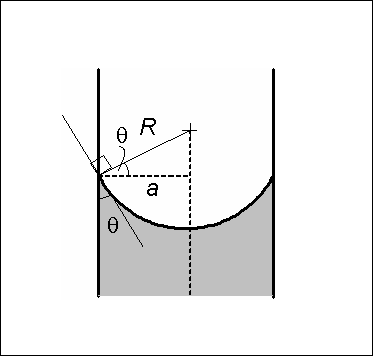 Konkave Meniskusmaßnahmen. Quelle: Wikimedia Commons
Konkave Meniskusmaßnahmen. Quelle: Wikimedia Commons Der konkave Meniskus zeichnet sich dadurch aus, dass der Kontaktwinkel θ, der die Glaswand mit einer Tangentenlinie zum Meniskus bildet, die in den Busen der Flüssigkeit eingeführt wird, einen Wert von weniger als 90 ° hat.
Wenn eine Flüssigkeitsmenge auf das Glas gelegt wird, verbreitet sie sich auf der Glasoberfläche.
Die Anwesenheit einer konkaven Menisc.
Daher badet oder benimmt die Flüssigkeit die Glaswand, bleibt eine Flüssigkeitsmenge und gibt dem Meniskus konkav. Wasser ist ein Beispiel für eine Flüssigkeit, die konkaven Meniskus bildet.
Konvexer Meniskus
Im Fall des konvexen Meniskus hat der Kontaktwinkel θ einen Wert von mehr als 90 °. Quecksilber ist ein Beispiel für eine Flüssigkeit, die konvexe Meniskus bildet. Wenn ein Tropfen Quecksilber auf eine Glasoberfläche platziert wird, hat der Kontaktwinkel θ einen Wert von 140 °.
Beobachtung einer konvexen Menisc. Es wird gesagt, dass die Flüssigkeit das Glas nicht nass macht.
Die oberflächlichen Kohäsionskräfte (Flüssigkeitsflüssigkeit) und Adhäsion (flüssig-solid) sind für viele Phänomene des biologischen Interesses verantwortlich, wie der Fall von Oberflächenspannung und Kapillarität.
Oberflächenspannung
Die Oberflächenspannung ist eine Netto -Anziehungskraft, die auf den auf der Oberfläche gefundenen Flüssigkeitsmolekülen ausgeübt wird und die sie in die Flüssigkeit einführt.
Kann Ihnen dienen: DiatomelementeDaher neigt die Oberflächenspannung dazu, die Flüssigkeit zu treten und konkavere Meniskus zu ergeben. Mit anderen Worten, diese Kraft neigt dazu, die Oberfläche der Glaswandflüssigkeit zu entfernen.
Die Oberflächenspannung nimmt tendenziell ab, wenn die Temperatur zunimmt, zum Beispiel: Die Oberflächenwasserspannung beträgt 0,076 n/m A 0 ° C und 0,059 n/m a 100 ° C.
Während die Oberflächenspannung des Quecksilbers bei 20 ° C 0,465 n/m beträgt. Dies würde erklären, warum Quecksilber einen konvexen Meniskus bildet.
Kapillarität
Wenn der Kontaktwinkel θ weniger als 90 ° beträgt und die Flüssigkeit die Glaswand benimmt, kann die Flüssigkeit in den Glaskapillaren bis zum Erreichen eines Gleichgewichtszustands aufsteigen.
Das Gewicht der flüssigen Säule wird durch die vertikale Komponente der Kohäsionskraft aufgrund der Oberflächenspannung kompensiert. Die Adhäsionskraft greift nicht ein, da sie senkrecht zur Rohroberfläche ist.
Dieses Gesetz erklärt nicht, wie Wasser durch die Xylemgefäße von den Wurzeln zu den Blättern aufsteigen kann.
Tatsächlich sind diesbezüglich andere Faktoren beteiligt, zum Beispiel: Wenn Wasser in den Blättern verdunstet, können die Wassermoleküle im oberen Teil der Kapillaren saugt werden.
Dies ermöglicht es anderen Molekülen am Boden der Kapillaren, die Stelle der verdampften Wassermoleküle zu besetzen.
Verweise
- Whitten, Davis, Peck & Stanley. Chemie. Cengage Lernen.
- Helmestine, Anne Marie, ph.D. Wie man Meniskus in Chemie liest. Von Thakedco erholt.com

