Eigenschaften, Typen und Funktionsauswahle
- 3088
- 1
- Lewis Holzner
Der Selectinas Sie sind eine Familie von Glykoproteinen. Aus diesem Grund werden sie auch Adhäsionsmoleküle bezeichnet.
Diese Adhäsionsrezeptoren sind für ihre erhaltene Struktur bekannt. Sie präsentieren drei Domänen und drei verschiedene Glykoproteine. Sie können als Oberflächenmoleküle exprimiert werden, zusätzlich zur gespeicherten oder funktionierenden Lösungsmoleküle.
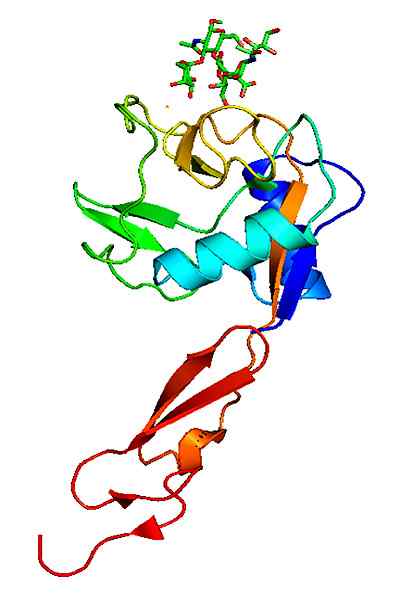
 Molekulare Struktur eines P-Selektin. Genommen und bearbeitet von: Neveu, Curtis [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]].
Molekulare Struktur eines P-Selektin. Genommen und bearbeitet von: Neveu, Curtis [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Im Gegensatz zu anderen Adhäsionsmolekülen wirken die Selectine nur in den Wechselwirkungen der weißen Blutkörperchen mit dem Gefäßendothel.
[TOC]
Eigenschaften
Die Selectine sind alle Proteine, die Ketten -Oligosaccharide enthalten, die durch kovalente Bindungen zu lateralen Aminosäurungsketten (Glykoproteine) vereint sind. Sie sind Transmembranmoleküle, was bedeutet, dass sie das Lipidbilay überqueren.
Sie teilen Merkmale, die Clec- oder Lectinas -Typ -C -Proteinen sehr ähnlich sind. Da ausgewählte Lektin als Typ C.
Der Ursprung des Wortes "Selectin" bezieht sich auf die Tatsache, dass diese Proteine in Gefäßsystemzellen selektiv exprimieren und auch eine Lectin -Domäne enthalten.
Einige Autoren enthalten Selectine (Glykoproteine) innerhalb der Lektin, weil es sich um Moleküle handelt, die an Zucker binden. Andere Autoren unterscheiden sie jedoch unter dem Konzept, dass Lektin nur Kohlenhydrate erkennen und sich ihnen anschließen, während Selectine nicht nur Zucker erkennen und sich zusammenschließen, sondern auch durch Kohlenhydrate gebildet werden.
Die Regulierung der Selectine erfolgt auf Transkriptionsebene, durch proteolytische Verarbeitung, durch zelluläre Klassifizierung und durch regulierte Ausdrücke von Glycosiltransferasen.
Die Selectine haben eine kurze intrazelluläre Domäne. Sie haben jedoch drei extrazelluläre Domänen, eine Domäne der Art des epidermalen Wachstumsfaktors, eine Domäne des Lektin -Typ -C- und Wiederholungseinheiten, ähnlich den regulatorischen Proteinen des Komplements.
Kann Ihnen dienen: Hele -Zellen: Geschichte, Eigenschaften, Zellzyklus und verwendetLeute
Die Selectin -Familie besteht aus drei verschiedenen Glykoproteinenarten. Jede von diesen wird mit einem Brief identifiziert, der den Ort bezeichnet, an dem sie zuerst identifiziert wurden. Als nächstes werden wir jeden von ihnen sehen.
L-Selectin
Es ist auch als Sell, CD62L, LAM1, Leu8, LNHR, LSEL oder TQ1 bekannt. Es kommt in Leukozyten vor, daher das "L" des Selectin. Es ist eine Zelloberflächenkomponente. Die drei Domänen sind: ein Gegenstück aus den Lektin, ein epidermaler Wachstumsfaktor und zwei Konsenseinheiten mit Wiederholungseinheiten.
Es präsentiert mehrere Liganden, dh im Allgemeinen kleine Moleküle, die Komplexen mit einer Biomolekül bilden, in diesem Fall ein Protein. Die bekannten Liganden für L-Selectin sind die folgenden.
Glycam1
Bekannt als das Molekül -1 von zellulärer Adhäsion, abhängig von der Glykosylierung, handelt.
CD34
Es handelt. Es wurde zuerst in hämatopoetischen Stammzellen beschrieben. Sie sind in einer Vielzahl von Zellen vorhanden, aber sie hängt fast ausschließlich mit der Hämatopojetik zusammen.
Madcam-1
Bekannt als AD -Harz- oder Zelladhäsionsmolekül in Richtung der Gefäßschleimhaut (in englischer Sprache, Molekül der Gefäßschleimhaut Adressinzelladhäsion 1). Es ist ein extrazelluläres Protein des Endothel.
PSGL-1
Unter anderem als Synonyme als Sublg oder CD162 bekannt ist, ist es ein Glykoprotein, das in Endothelzellen und in Leukozyten vorkommt. Sie können sich den beiden anderen Arten von Selectins anschließen. Es scheint jedoch, dass es eine bessere Affinität zu P-Selectin darstellt.
Kann Ihnen dienen: Pilzzellen: Eigenschaften, Organellen und FunktionenP-Selectin
P-Selectin ist unter anderem unter anderen Namen wie SELP, CD62, CD62P, GMP140, GRMP oder LeCAM3 bekannt. Es befindet sich auf der Oberfläche der Endothelzellen, die die inneren Ränder von Blutgefäßen und Blutplättchen bedecken.
P-Selectin wurde erstmals in Blutplättchen identifiziert. Deshalb trägt der Name des Proteins das anfängliche "P".
Die Struktur des P-Selectin besteht aus einer Domäne, die dem Typ-C-Lectin am n EGF-Ende sehr ähnlich ist; das heißt eine konservierte Proteindomäne von etwa 30 bis 40 Aminosäureabfällen mit einem Zwei-Kategoraren-β-Blatt, gefolgt von einer Schleife bis zu einem Kurz-terminalen bikatenären β-terminalen Blatt.
Es präsentiert eine dritte Doming, die dem genannten Komplement -Protein ähnelt, wie z.
Der Ligand mit größerer Affinität des P-Selectin ist psgl-1, wie zuvor in den L-Selectin-Liganden beschrieben. Andererseits kann dieses Protein auch Komplexe mit anderen Molekülen wie sulfatiertem Polysaccharid namens Fucoidan und Heparán -Sulfat bilden.
E-Selectin
Dieses Selectin -Protein ist auch unter folgenden Namen bekannt: SELE, CD62E, Elam, Elam1, Esel, Lecam2 und andere. Es wird ausschließlich in Endothelzellen exprimiert, die durch kleine Proteine aktiviert werden, die nicht in der Lage sind, die Lipiddoppelschicht der Zelle zu überqueren.
Die Struktur dieses Proteins besteht aus 3 Domänen (z.
Es kann Ihnen dienen: Megakariozyten: Eigenschaften, Struktur, Bildung, Reifung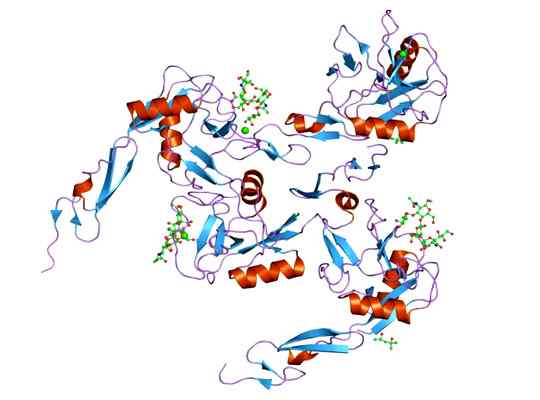 Darstellung der molekularen Struktur des E-Selectin-Proteins, dessen Domino EGF ist. Genommen und bearbeitet von: Jawahar Swaminathan und MSD -Mitarbeitern am Europäischen Bioinformatikinstitut [Public Domain].
Darstellung der molekularen Struktur des E-Selectin-Proteins, dessen Domino EGF ist. Genommen und bearbeitet von: Jawahar Swaminathan und MSD -Mitarbeitern am Europäischen Bioinformatikinstitut [Public Domain]. Der Ligand, der Komplexe mit dem E-Selektiv bildet, sind sehr unterschiedlich, aber diejenigen, die hervorstechen.
Sialyl-Lewis a
Auch als SLE A O CA19-9 bezeichnet. Es ist ein Tetrasaccharid bei Seren von Krebspatienten. Es ist bekannt, dass es am Zell-Zell-Erkennungsprozess teilnimmt. Es wird konstitutiv in Granulozyten, Monozyten und Lymphozyten t exprimiert.
Sialyl-Lewis x
Es ist auch ein Tetratasaccharid wie Sialyl-Lewis A und hat ähnliche Funktionen. Es wird in Granulozyten und Monozyten exprimiert und kontrolliert den unerwünschten Ausgang oder Leckagen dieser Zellen während der Entzündung.
PSGL-1
Während es in P-Selectin offenbar effizienter ist, sind einige Autoren der Ansicht, dass die von menschlichem Neutrophilen abgeleitete Form auch bei E-Selectin recht effizient ist. Tatsächlich sind sie der Ansicht, dass dieser Ligand im Allgemeinen für die drei Arten von Selectinen von grundlegender Bedeutung ist.
Funktion
Die Hauptfunktion der Selectine besteht darin, Teil des Bildungsprozesses für weiße Blutkörperchen (Lymphozyten) zu sein. Sie beteiligen sich auch an der Immunantwort, an chronischen und akuten Entzündungen in verschiedenen Körperorganen wie Nieren, Herz und Haut. Sie wirken sogar in den entzündlichen Prozessen krebserregender Metastasen.
Verweise
- SelectIn. Abgerufen von: in.Wikipedia.Org.
- L-Selectin. Abgerufen von: in.Wikipedia.Org.
- CA19-9. Abgerufen von: in.Wikipedia.Org.
- E-Selectin. Abgerufen von: in.Wikipedia.Org.
- X. Zou, v.R. Shinde Patil, n.M. Dagia, l.ZU. Smith, m.J. Wargo, k.ZU. Intergi, c.M. Lloyd, d.F. Tees, b. Walcheck, m.B. Lawrence, d.J. Goetz (2005). PSGL-1, die aus menschlichen Neutrophilen städt. American Journal of Physiology. Zellphysiologie.
- K. Gesetz (2001). Funktionen von Selectins. Ergebnisse und Probleme bei der Zelldifferenzierung.
- Selectinas. Erholt von: Brunnenpfad.Uniovi.Ist.
- J.H. Pérez & C.J. Montoya. Adhäsionsmoleküle. Abgerufen von: Encolombia.com.
- ZU.C. Sanguineti & J.M Rodríguez-Tafur (1999). Adhäsion und Hautmoleküle. Peruanische Dermatologie.
- T.F. Tedder, d.ZU. Steeber, a. Chen, p. Engel (1995). Die Selectine: Gefäßadhäsionsmoleküle. Faseb Journal.
- « Weiße Mangrovenmerkmale, Lebensraum, Taxonomie, verwendet
- Integrine -Eigenschaften, Struktur und Funktionen »

