SGLT (Natrium-Glucose-Transportproteine)
- 4386
- 936
- Frederike Birkemeyer
Der Natriumglucose-Transportproteine (SGLT) Sie sind für den aktiven Glukosetransport in Säugetierzellen gegen einen Konzentrationsgradienten verantwortlich. Die Energie, die für diesen Transport erforderlich ist, wird aus dem Natrium Cotransport in die gleiche Richtung (Simport) erfasst (Simport).
Seine Lage ist auf die Membran der Zellen beschränkt, die das epitheliale Gewebe bilden, das für die Absorption und Reabsorption von Nährstoffen verantwortlich ist (dünner Darm und proximal konturiertes Tubulus der Niere).
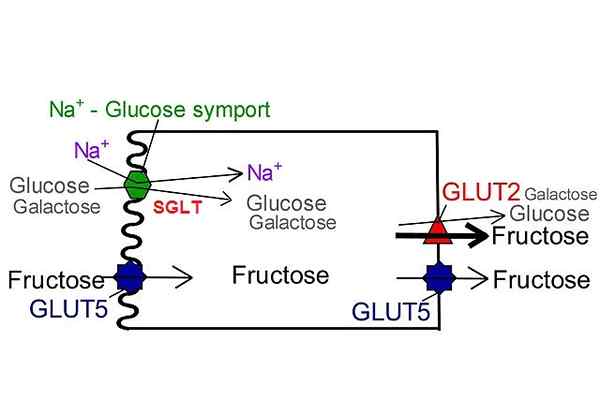
 SGLT -Glucosetransporter im Gegensatz zu Glut. Von NUFS, San Jose State University [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)], modifiziert von Wikimedia Commons.
SGLT -Glucosetransporter im Gegensatz zu Glut. Von NUFS, San Jose State University [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)], modifiziert von Wikimedia Commons. Bisher wurden nur sechs Isoformen zu dieser Familie von Transportern beschrieben: SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 und SGLT-6. In allen von ihnen liefert der durch den Transport des Natriumion erzeugte elektrochemische Strom Energie und induziert die Konformationsänderung der Struktur des erforderlichen Proteins, um den Metaboliten auf der anderen Seite der Membran zu translozieren.
Alle diese Isoformen unterscheiden sich jedoch voneinander, indem sie Unterschiede in:
- Der Grad der Affinität, den sie für Glukose haben,
- Die Fähigkeit zur Durchführung von Glukose-, Galactose- und Aminosäuretransport,
- Der Grad, in dem sie von Florizina und gehemmt werden
- Die Gewebestelle.
[TOC]
Molekulare Mechanismen des Glukosetransports
Glucose ist ein Monosaccharid von sechs Kohlenstoffatomen, das von den meisten vorhandenen Zelltypen verwendet wird, um Energie durch metabolische Oxidationswege zu erhalten.
Angesichts seiner großen Größe und ihrer im Wesentlichen hydrophilitischen Natur kann es die Zellmembranen nicht durch freie Diffusion überqueren. Daher hängt seine Cytosolmobilisierung von Transportproteinen in diesen Membranen ab.
Bisher untersuchte Glukosetransporter führen den Transport dieses Metaboliten durch passive oder aktive Transportmechanismen durch. Der passive Transport unterscheidet sich vom aktiven Transport, bei dem keine Energieversorgung durchgeführt wird, da er zugunsten eines Konzentrationsgradienten auftritt.
Es kann Ihnen dienen: Epidermis der ZwiebelDie am passiven Glukosetransport beteiligten Proteine gehören zur Familie der disseminierten Verbrennungstransporter, die vom Akronym in englischer Sprache des Begriffs "Glukosetransporter" bezeichnet werden, so. Während diejenigen, die einen aktiven Transport ausführen, von "Natrium-Glucose-Transportproteinen" als SGLT bezeichnet wurden, wurden als SGLT bezeichnet.
Letztere erhalten die notwendige freie Energie, um den Transport von Glukose gegen den Konzentrationsgradienten des Natriumionen -Cotransports durchzuführen. Es wurden mindestens 6 SGR -Isoformen identifiziert und seine Position scheint auf Epithelzellmembranen beschränkt zu sein.
SGLT -Eigenschaften
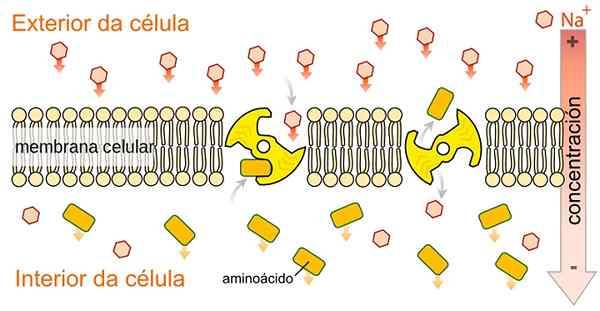 SLgt Simport Trainer sind nicht spezifisch für Glukose, sie können eine andere Vielfalt von Metaboliten wie Aminosäuren, Galactose und andere Metaboliten transportieren, da sie die von Natriumionen Cotransport freigesetzte Energie zugunsten ihres Konzentrationsgradienten verwenden. Von Speciladyofhats [CC0 (https: // creativecommons.Org/lizenzen/by-sa/4.0) aus Wikimedia Commons.
SLgt Simport Trainer sind nicht spezifisch für Glukose, sie können eine andere Vielfalt von Metaboliten wie Aminosäuren, Galactose und andere Metaboliten transportieren, da sie die von Natriumionen Cotransport freigesetzte Energie zugunsten ihres Konzentrationsgradienten verwenden. Von Speciladyofhats [CC0 (https: // creativecommons.Org/lizenzen/by-sa/4.0) aus Wikimedia Commons. Wie durch seinen Namen angezeigt, führen die Natriumglucosetransportproteine den Simport-Typ von Natrium und Glucose oder Natrium und Galactose-Zytosol zum zellulären Cytosol durch.
Der Natriumtransport zugunsten eines Konzentrationsgradienten ist dafür verantwortlich, unverzichtbare freie Energie zu erzeugen, um Glukose von einer niedrigen Konzentrationszone zu einer hohen Konzentration zu mobilisieren.
Diese Transporter sind Teil einer Gruppe von Anti -Transport- und Sympathieprotein von Natrium und Wasserstoff, deren Gene nicht phylogenetisch miteinander verbunden sind.
Seine Lage ist auf die Luminalmembran der Epithelzellen von Geweben beschränkt.
Kann Ihnen dienen: coxiella burnetiiSGLT -Typen
Bisher wurden sechs SGLT-Transporter (SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 und SGLT-6) identifiziert. Alle zeigen Unterschiede in der Präferenz des Transports von Glukose oder Galactose, der Affinität, die sie für diese Zucker und das Natrium vorlegen und durch die Tatsache, dass sie durch Florizina gehemmt werden können.
SGLT1 hat die Fähigkeit, auch Galactose zu transportieren, zusätzlich zu Glucose mit einer sehr ähnlichen Kinetik, während SGLT2 nur Glukose transportiert.
GSLT -Struktur
Die Länge der Peptidsequenz von SGLT -Proteinen reicht von 596 bis 681 Aminosäureabfällen. In der Zwischenzeit variieren die Homologie-Prozentsätze zwischen den Sequenzen zwischen 50 und 84 % in Bezug auf SGLT-1, was der größte Divergenzgrad in den Sequenzen ist, die der extrazellulären Amino-End- und terminalen Carboxyls entsprechen.
Die allgemeine Struktur fällt mit der eines Multipaso -Integralproteins zusammen, dh der Membran mehrmals durch Transmembrandomänen, die reich an hydrophoben Aminosäuren sind.
Diese Transmembrandomänen sind insgesamt 14 und jede von ihnen hat eine sekundäre α-Helix. Die Segmente 1, 2, 5, 7 und 9 sind räumlich in einer zentralen Position organisiert, die zur Bildung von hydrophiler Pore entsteht.
Durch hydrophile Porentransitionen Glukose sowie alle anderen Metaboliten, für die der Transporter eine Affinität haben kann. Die verbleibenden helikalen Fragmente sind parallel organisiert, um dem Kanal eine größere strukturelle Stabilität zu verleihen.
SGLT Funktionen
Mitglieder der SGLT -Familie zeigen keine einzigartige Spezifität für Glukose. Im Gegensatz.
Die Funktion dieser Art von Transportern, die weiter untersucht wurden.
Es kann Ihnen dienen: Vergleichende Embryologie: Was ist es, welche Studien, Geschichte, TheorienDieser Reabsorptionsprozess beinhaltet die Mobilisierung von Kohlenhydraten aus Nieren -Tubuli über tubuläre Epithelzellen bis zum Lumen der peritubulären Kapillaren. Die Isoform mit hoher Kapazität und Affinität für Glucose SGLT-2 ist der Hauptsteuerzahler.
Die Glucose-Absorptionsfunktion im Darmtrakt wird SGLT-1 zugeschrieben, einem Förderer, der trotz geringer Kapazität eine hohe Affinität zur Glukose aufweist.
Das dritte Mitglied dieser Familie, SGLT3, wird in den Membranen der Skelettmuskelzellen und des Nervensystems exprimiert, wo es nicht als Glukosetransporter, sondern als Sensor der Konzentrationen dieses Zucker im extrazellulären Medium zu wirken scheint.
Die Funktionen von SGLT4-, SGLT5- und SGLT6 -Isoformen waren bisher nicht sicher.
Verweise
- Abramson J, Wright Em. Struktur und Funktion von NA -Symportern mit umgebundenen Wiederholungen. Strömungsstruktur Biol. 2009; 19: 425-432.
- Alvarado F, Crane RK. Untersuchungen zum Mechanismus der Darmabsorption von Zucker. Vii. Phenylgllykosidtransport und seine mögliche Beziehung zur Phorizin -Hemmung des Actice -Transports von Sugs durch den kleinen Anfall. Biochim Biophys Act. 1964; 93: 116-135.
- Charron FM, Blanchard MG, Lapointe JY. Die intrazelluläre Hypertonizität ist für den Wasserfluss verantwortlich. Biophys J. 2006; 90: 3546-3554.
- Chen XZ, Coady MJ, Lapointe JY. Schnelle Spannungsklemme dispels zu einer neuen Komponente von Perparaturstaatströmen aus dem Na_-Glucose-Cotransporter. Biophys J. neunzehn sechzig sechs; 71: 2544-2552.
- Dyer J, Wood IS, Palejwala A, Ellis A, Shirazi-Beechey SP. Expression von Monosaccharidtransportern im Darm diabetischer Menschen. Am J Physiol gastrointer Leberphysiol. 2002; 282: G241-G248.
- Sátk M, Marks J, Unwin RJ. Mutmaßliche Gewebestelle und Funktion des SLC5 -Familienmitglieds SGLT3. Exp Physiol. 2017; 102 (1): 5-13.
- Türk E, Wright Em. Membrantopologiemotive in der Familie SGG Cotransporter. J Memb Biol. 1997; 159: 1-20.
- Turk E, Kim O, Him J, Whitelegge JP, Eskandari S., Lam JT, Kreman M, Zampighi G, Faull, Wright Em. Molekulare Charakterisierung von Vibrio parahaemolyticus VSGLT: Ein Modell für Natrium-gekoppelte Zucker-Cotransporters. J Biol Chem. 2000; 275: 25711-25716.
- Taroni C, Jones S, Thornton JM. Analyse und Vorhersage von Kohlenhydratbindungsstellen. ENG Protein. 2000; 13: 89-98.
- Wright EM, Loo DD, Hirayama BA. Biologie menschlicher Natriumglukosetransporter. Physiol Rev. 2011; 91 (2): 733-794.

