Ethylether

- 866
- 245
- Ibrahim Steuk
 Der Ethylether ist eine flüchtige und brennbare Flüssigkeit, die im neunzehnten Jahrhundert als Betäubung diente
Der Ethylether ist eine flüchtige und brennbare Flüssigkeit, die im neunzehnten Jahrhundert als Betäubung diente Was ist Ethylether??
Er Ethylether, Auch als Dietyl -Ether bekannt, handelt es sich um eine organische Verbindung, deren chemische Formel C ist4H10ENTWEDER. Es ist gekennzeichnet, indem es eine farblose und flüchtige Flüssigkeit ist, und daher müssen seine Flaschen so fest wie möglich geschlossen gehalten werden.
Dieser Äther. Das heißt, sie haben die ROR -Formel, in der R und R 'unterschiedliche kohlensäurehaltige Segmente darstellen. Und wie unter seinem zweiten Namen, Dietyl Ether, zwei Radikale, die mit dem Sauerstoffatom verbunden sind.
Anfangs wurde der Ethylether als Vollnarkose verwendet, der 1846 von William Thomas Green Morton eingeführt wurde. Aufgrund seiner Entflammbarkeit wurde jedoch die Verwendung verworfen, wodurch sie durch andere weniger gefährliche Anästhesie ersetzt wurde.
Diese Verbindung wurde auch verwendet, um die Blutkreislaufzeit während der Bewertung des kardiovaskulären Status des Patienten zu berechnen.
Ethyletherstruktur
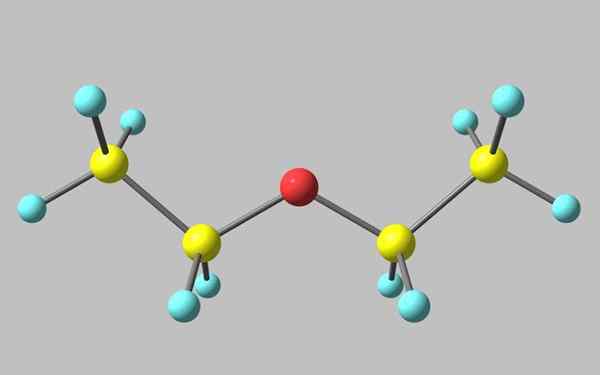 Chemische Struktur von Ethylether
Chemische Struktur von Ethylether Im überlegenen Bild gibt es eine Darstellung mit einem Modell von Kugeln und Balken der molekularen Struktur des Ethylethers.
Wie zu sehen ist, hat die rote Kugel, die dem Sauerstoffatom entspricht, zwei Ethylgruppen, die mit beiden Seiten verbunden sind. Alle Links sind einfach, flexibel und freie Drehung um die Achsen σ.
Diese Rotationen entstehen Stereoisomere, die als Konformere bekannt sind, die mehr als Isomere alternative räumliche Zustände sind. Die Bildstruktur entspricht genau dem Anti -Konformer, in dem alle Atomgruppen gestaffelt sind (voneinander getrennt).
Der andere Konfruero ist in den Schattenstrengung und obwohl es nicht sein verfügbares Bild ist, reicht es aus, es mit einem U -Shaped zu visualisieren. An den oberen Enden der U würden sich die Methylgruppen befinden, -ch3, Das würde sterische Abstoßungen erleben (sie würden im Weltraum kollidieren).
Kann Ihnen dienen: Faraday konstantDaher ist zu erwarten, dass Chos Molekül3CH2Och2CH3 die meiste Zeit Anti -Formation übernehmen.
Physikalische und chemische Eigenschaften der Ethylether
Andere Namen
- Diethylether
- Etoxytano
- Ethyloxid
Molekularformel
C4H10O o (c2H5)2ENTWEDER.
Molekulargewicht
74.14 g/mol.
Aussehen
Farblose Flüssigkeit.
Geruch
Süß und würzig.
Geschmack
Brennen und süß.
Siedepunkt
94.3 ° F (34.6 ° C) bei 760 mm Hg.
Schmelzpunkt
-177.3 ° F (-116).3 ° C). Stabile Kristalle.
Zündungspunkt
-49 ° F (geschlossener Behälter).
Wasserlöslichkeit
6.04 g/100 ml bei 25 ° C.
Löslichkeit in anderen Flüssigkeiten
Mischbar mit aliphatischen, Benzol, Chloroform, Ölether, Fettlösungsmittel, vielen Ölen und konzentrierter Salzsäure mischbar.
Löslich in Aceton und sehr löslich in Ethanol. Es ist auch löslich in Benzin, Benzol und Ölen.
Dichte
0.714 mg/ml bei 20 ° C (68 ° F).
Dampfdichte
2.55 (in Bezug auf Luft mit Dichte 1).
Dampfdruck
442 mm Hg bei 68 ° F. 538 mm Hg bei 25 ° C. 58,6 kPa bei 20 ° C.
Stabilität
Es wird langsam durch die Wirkung von Luft, Luftfeuchtigkeit und Licht mit Peroxidenbildung oxidiert.
Die Bildung von Peroxiden kann in den offenen und mehr als sechs Monaten im Lager von Ätherbehältern auftreten. Peroxide können Reibung, Aufprall oder Erwärmung auslösen.
Sein Kontakt mit: Zink, Halogenen, nicht -metallische Oxihaluros, starke Oxidationsmittel, Chromylchlorid, Treeminöle, Nitrate und Metallchloride sollten vermieden werden.
Selbstzündung
180 ° C (356 ° F).
Zersetzung
Wenn er sich erwärmt, bricht er zusammen, gibt einen Hektar aus und irritierende Rauch.
Schmiere
0.2448 Haufen bei 20 ° C.
Verbrennungswärme
8.807 kcal/g.
Es kann Ihnen dienen: Einstenio (s): Struktur, Eigenschaften, erhalten, verwendet, verwendetVerdampfungswärme
89.8 Kalk/g A 30 ° C.
Oberflächenspannung
17.06 Dynas/cm bei 20 ° C.
Ionisationspotential
9.53 ev.
Riechschwelle
0.83 ppm (Reinheit ist nicht gegeben).
Brechungsindex
1.355 bis 15 ° C.
Erhalten der Ethylether
Ethylether aus Ethylalkohol kann in Gegenwart von Schwefelsäure als Katalysator erhalten werden. Schwefelsäure in einem wässrigen Medium dissoziiert das Hydroniumionen H3ENTWEDER+.
Im entgegengesetzten Verfahren, dh die Hydratation von Ethylen in der Dampfphase, kann sich Ethylether neben Ethylalkohol als Kollateralprodukt bilden. Tatsächlich erzeugt dieser synthetische Weg den größten Teil dieser organischen Verbindung.
Toxizität von Ethylether
Es kann Haut- und Augenreizungen erzeugen. Der Hautkontakt kann zu Resektion und Rissen führen. Der Äther dringt normalerweise nicht in die Haut ein, da er schnell verdampft wird.
Die durch den Äther verursachte Reizung der Augen ist normalerweise mild, und bei schweren Reizungen ist der Schaden im Allgemeinen reversibel.
Seine Einnahme erzeugt Narkotikeffekte und Magenreizungen. Starke Einnahme kann Nierenschäden verursachen.
Äthereinhalation kann Nasen- und Rachenreizungen verursachen. Im Falle einer Äthereinhalation kann es erzeugt werden: Schläfrigkeit, Aufregung, Schwindel, Erbrechen, unregelmäßige Atmung und Speichelfluss erhöhen.
Eine hohe Exposition kann zu Wissensverlust und sogar zum Tod führen.
Die OSHA legt während einer 8 -Stunde.
Augenreizwerte: 100 ppm (Menschen). Augenreizwerte: 1200 mg/m3 (400 ppm).
Verwendet/Anwendungen der Ethylether
Organische Lösung
Es ist ein organisches Lösungsmittel, das zur Auflösung von Brom, Jod und anderen Halogenen verwendet wird. Die meisten Lipide (Fette), Harze, reine Gummi, einige Alkaloide, Gummi, Parfums, Celluloseacetat, Cellulosenitrat, Kohlenwasserstoffe und Farbstoffe.
Es kann Ihnen dienen: Keine Metalle: Geschichte, Eigenschaften, Gruppen, VerwendungenDarüber hinaus wird es bei der Extraktion der Wirkstoffe von Tier- und Pflanzengeweben verwendet, da es weniger Dichte als das Wasser aufweist und darauf schwimmt, sodass die gewünschten Substanzen im Äther gelöst werden.
Vollnarkose
Es wird seit 1840 als Vollnarkose verwendet und ersetzt Chloroform für einen therapeutischen Vorteil. Es handelt sich jedoch um eine brennbare Substanz und findet daher schwerwiegende Schwierigkeiten bei der Verwendung in klinischen Bereichen.
Darüber hinaus produziert es bei Patienten einige unerwünschte postoperative Nebenwirkungen wie Übelkeit und Erbrechen.
Aus diesen Gründen wurde die Verwendung des Äthers als Vollnarkose verworfen, wodurch er durch andere Anästhesie wie Halotano ersetzt wurde.
Äthergeist
Äther gemischtes Ethanol.
Durchblutungsbewertung
Der Äther wurde verwendet, um die Durchblutung zwischen einem Arm und der Lunge zu bewerten. Der Äther wird in einen Arm injiziert und das Blut zum rechten Atrium, dann zum rechten Ventrikel und von dort in die Lunge gebracht.
Die Zeit, die sich von der Injektion des Äthers bis zur Einnahme des Geruchs des Äthers in der ausgeatmten Luft vergrößert, beträgt ungefähr 4 bis 6 s.
Laboratorien unterrichten
Der Äther wird in vielen Experimenten zum Unterrichten von Labors verwendet. Zum Beispiel bei der Demonstration von Mendels Gesetzen der Genetik.
Der Äther wird verwendet, um die Geschlechtsfliegen zu betäuben Drosophila und lassen Sie die notwendigen Kreuze zwischen ihnen, um die Gesetze der Genetik hervorzuheben.
Verweise
- Graham Solomons t.W., Craig b. Braten. Organische Chemie. Amine. Wiley Plus.
- Ethher Ether. Von Britannica geborgen.com

