Zinnoxid (ii) Struktur, Eigenschaften, Nomenklatur, verwendet

- 970
- 143
- Timo Rabenstein
Er Zinnoxid (ii) Es handelt+. Seine chemische Formel ist Sno. Zwei verschiedene Wege dieser Verbindung sind bekannt: das Schwarze und das Rot. Die häufigste und stabilste Form bei Raumtemperatur ist eine schwarze oder schwarzblaue Modifikation.
Diese Form wird durch Zinnchloridhydrolyse (II) (SNCL2) In wässriger Lösung, zu der Ammoniumhydroxid zugesetzt wird (NH4OH) um einen hydratisierten Oxid -Niederschlag aus sn (ii) zu erhalten, dessen Formel Sno ist.Xh2Oder wo x<1 (x menor que 1).
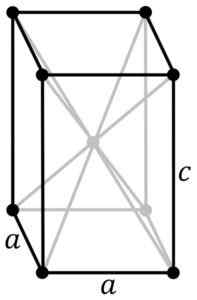 Tetragonale kristalline Struktur des schwarzblauen SNO. Das SN -Atom befindet sich in der Mitte der Struktur- und Sauerstoffatome in den Eckpunkten der Parallelepiped. Original PNGs von Benutzer: Rocha, in Inkscape von Benutzer verfolgt: Stannered [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]] Quelle: Wikipedia Commons
Tetragonale kristalline Struktur des schwarzblauen SNO. Das SN -Atom befindet sich in der Mitte der Struktur- und Sauerstoffatome in den Eckpunkten der Parallelepiped. Original PNGs von Benutzer: Rocha, in Inkscape von Benutzer verfolgt: Stannered [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]] Quelle: Wikipedia Commons Hydratisiertes Oxid ist ein weißer amorpher Feststoff, der dann in Gegenwart von NH mehrere Stunden lang in Suspension auf 60-70 ° C erhitzt wird4Oh, bis du das schwarze kristalline reine Sno bekommst.
Die rote Form des SNO ist metastabil. Es kann durch Zugabe von Phosphorsäure (H) hergestellt werden3Po4) - mit 22% Phosphorsäure, H3Po3 - Und dann nh4Oh eine SNCL -Lösung2. Der erhaltene weiße Feststoff wird in derselben Lösung für etwa 10 Minuten auf 90-100 ° C erhitzt. Auf diese Weise wird die reine rote kristalline SNO erhalten.
Zinnoxid (II) ist ein Ausgangsmaterial für die Herstellung anderer Zinnverbindungen (II). Aus diesem Grund ist es eine der Zinnverbindungen, die eine nennenswerte kommerzielle Bedeutung hat.
Zinnoxid (ii) zeigt eine geringe Toxizität wie bei den meisten Zinn -in -organischen Verbindungen. Dies liegt an ihrer schlechten Absorption und einer schnellen Ausscheidung von Lebewesen Stoffe.
Es kann Ihnen dienen: Knacker Beraral: Was ist, Merkmale, wofür ist esPräsentiert eine der größten Toleranzen an Zinnverbindungen in Tests, die mit Ratten durchgeführt werden. Es kann jedoch schädlich sein, wenn es in großen Mengen eingeatmet wird.
[TOC]
Struktur
Zinnoxid (ii) schwarzblau
Diese Modifikation kristallisiert mit der tetragonalen Struktur. Es hat eine Ebene arrangieren.
Andere Forscher bestätigen, dass jedes SN -Atom von 5 Sauerstoffatomen umgeben ist, die ungefähr in den Eckpunkten eines Oktaeders liegen, wo der sechste Scheitelpunkt vermutlich von zwei freien oder nicht gepaarten Elektronen besetzt ist. Dies ist als φ-octic-Anordnung bekannt.
Rotes Oxid (II)
Diese Form von Zinnoxid (II) kristallisiert mit ortorrombischer Struktur.
Nomenklatur
- Zinnoxid (ii)
- Estany -Oxid
- Zinnmonoxid
- Estany -Oxid
Eigenschaften
Körperlicher Status
Kristalline Feststoff.
Molekulargewicht
134,71 g/mol.
Schmelzpunkt
1080 ºC. Es zersetzt sich.
Dichte
6,45 g/cm3
Löslichkeit
Unlöslich in kaltem oder heißem Wasser. In Methanol unlöslich, aber es löst sich schnell in Säuren und konzentrierten Alkalien auf.
Andere Eigenschaften
Wenn mehr als 300 ° C in Gegenwart von Luft erhitzt werden, wird das Zinnoxid (II) in Zinnoxid (iv) schnell oxidiert, was eine Glühlampe aufweist.
Es wurde berichtet, dass unter nicht oxidativen Bedingungen Zinnoxid (II) -Heizung nach dem Grad der Reinheit des Startoxids verschiedene Ergebnisse erzielt. Es ist im Allgemeinen überproportional in metallischen SN und Zinnoxid (IV), SNO2, Mit verschiedenen Zwischenarten, die schließlich SNO werden2.
Zinnoxid (II) ist Amphotero, da es in Säuren gelöst ist, um SN -Ionen zu ergeben2+ oder Anionenkomplexe und löst sich auch in Alkalien auf, um Hydroxy-Stanning-Ionenlösungen zu bilden, SN (OH)3-, die eine Pyramidenstruktur haben.
Es kann Ihnen dienen: Perchlorsäure: Formel, Eigenschaften und VerwendungDarüber hinaus ist der SNO ein Reduktionsmittel und reagiert schnell mit organischen Säuren und Mineralien.
Es zeigt eine geringe Toxizität im Vergleich zu anderen Blechsalz. Sein DL50 (50% tödliche Dosis oder mittelgroße Dosis) bei Ratten beträgt mehr als 10000 mg/kg. Dies bedeutet, dass mehr als 10 Gramm pro Kilogramm erforderlich sind, um 50% der Rattenproben unter einem bestimmten Versuchszeitraum abzutöten. Im Vergleich dazu präsentiert Zinnfluorid (ii) einen 188 mg/kg DL50.
Wenn es jedoch für lange Zeit eingeatmet wird, wird es in der Lunge abgelagert, da es nicht absorbiert ist und Zinn produzieren kann (Infiltration des Sno -Staubes in den Lungenweins).
Anwendungen
In der Herstellung anderer Blechverbindungen (II)
Seine schnelle Reaktion mit Säuren ist die Grundlage für die wichtigste Verwendung, die als Vermittler bei der Herstellung anderer Blechverbindungen ist.
Es wird bei der Herstellung von Zinnbromid (ii) (SNBR2), Zinncyanid (ii) (sn (cn)2) und Zinnfluoroborat Hydrat (ii) (SN (BF)4)2) Unter anderen Zinnverbindungen (ii).
Zinnfluoroborat (ii) wird durch Auflösen von SNAM hergestellt. Dies ist unter anderem auf seine hohe Abdeckungskapazität zurückzuführen.
Zinn (ii) Oxid wird auch in der Zinnsulfatvorbereitung (ii) (SNSO) verwendet4) durch Sno- und Schwefelsäure -Reaktion H2SW4.
Der SNSO4 Erhalten, es wird im Dose -Prozess für die Herstellung von gedruckten Schaltplatten, für die elektrische Kontaktfläche und für die Küchenutensilien verwendet.
Kann Ihnen dienen: Aluminiumcarbonat: Struktur, Eigenschaften, verwendet Leiter. Kein maschinenlesbarer Autor zur Verfügung gestellt. Abraham del Pozo nahm an (basierend auf Urheberrechtsansprüchen). [Public Domain] Quelle: Wikimedia Commons
Leiter. Kein maschinenlesbarer Autor zur Verfügung gestellt. Abraham del Pozo nahm an (basierend auf Urheberrechtsansprüchen). [Public Domain] Quelle: Wikimedia Commons Die hydratisierte Form des SNO, der Zinnhydrotado (ii) SNO.Xh2Oder es wird mit Fluorhorsäure behandelt, um Zinnfluorid (II), SNF zu erhalten2, die zu dentifrischen Cremes als Mittel zur Bekämpfung von Karies hinzugefügt wird.
Im Schmuck
Zinnoxid (II) wird zur Herstellung von Gold-Stretch- und Kupferstubs-Kristallen verwendet. Anscheinend ist seine Funktion in dieser Anwendung, als Reduktionsagenten zu fungieren.
 Juwel mit Rubin. Quelle: Pixabay
Juwel mit Rubin. Quelle: Pixabay Andere Verwendungen
Es wurde in Photovoltaik -Geräten zur Erzeugung von Elektrizität aus Licht wie Solarzellen verwendet.
 Photovoltaikvorrichtung. Georg Slickers [CC BY-SA 2.5 (https: // creativecommons.Org/lizenzen/by-sa/2.5)] Quelle: Wikipedia Commons
Photovoltaikvorrichtung. Georg Slickers [CC BY-SA 2.5 (https: // creativecommons.Org/lizenzen/by-sa/2.5)] Quelle: Wikipedia Commons Jüngste Innovationen
Sno-geordnete Nanopartikel wurden in Kohlenstoffnanoröhrenelektroden für Lithium-Sugar-Batterien verwendet.
 Sno Hydrat -Nanofasern. Fionán [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] Quelle: Wikipedia Commons
Sno Hydrat -Nanofasern. Fionán [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] Quelle: Wikipedia Commons SNO -vorbereitete Elektroden weisen eine hohe Leitfähigkeit und eine geringe Änderung des Volumens bei sich wiederholenden Lade- und Download -Zyklen auf.
Darüber hinaus erleichtert der SNO einen schnellen Ionen-/Elektronenübertragung während der Oxidationsreduzierungsreaktionen, die im solchen Batteriesystem auftreten.
Verweise
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Tanz, j.C.; Emeléus, h.J.; Sir Ronald Nyholm und Trotman-Deckenson, um.F. (1973). Umfassende anorganische Chemie. Band 2. Pergamon Press.
- Ullmanns Enzyklopädie der industriellen Chemie. (1990). FÜNFTE AUSGABE. Band A27. VCH Verlagsgellschaft MBH.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 24. Vierte Edition. John Wiley & Söhne.
- Ostrakhovitch, Elena zu. Und Cherian, m. George. (2007). Zinn. Im Handbuch der Toxikologie von Metallen. Dritte Edition. Von Scientedirect erholt.com.
- Kwestroo, w. und Vromans, p.H.G.M. (1967). Herstellung von drei Modifikationen von reinem Zinn (II) Oxid. J. Inorg. Nukl. Chem., 1967, vol.29, pp.2187-2190.
- Foud, s.S et al. (1992). Optische Eigenschaften von Stannous -Oxid -Dünnfilmen. Tschechoslowak Journal of Physics. Februar 1992, Band 42, Ausgabe 2. Von Springer geborgen.com.
- A-Young Kim et al. (2017). Bestellte Sno-Nanopartikel in MWCNT als funktionelles Wirtsmaterial für hochrate Lithium-Sulfur-Batteriekathoden. Nano Research 2017, 10 (6). Von Springer geborgen.com.
- Nationalbibliothek für Medizin. (2019). Stannous Oxid. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- « Jacquard Loom History, Operation, verwendet, verwendet
- Funktionalismus (Architektur) Geschichte, Eigenschaften, Werke »

