Lineare Alcanos -Struktur, Eigenschaften, Nomenklatur, Beispiele

- 4400
- 270
- Frederike Birkemeyer
Der Lineare Alkane Sie sind gesättigte Kohlenwasserstoffe, deren allgemeine chemische Formel ist N-CNH2n+2. Als gesättigte Kohlenwasserstoffe sind alle Bindungen einfach (c-h) und bestehen nur aus Kohlenstoff- und Wasserstoffatomen. Sie erhalten auch den Namen von Paraffins und unterscheiden sie von den verzweigten Toums, zu denen sie Isoparafinas genannt werden.
Diese Kohlenwasserstoffe haben keine Auswirkungen und Ringe. Diese Familie von organischen Verbindungen ähnelt mehr als Linien mehr als Ketten mehr (gerades Kettenalkan); oder von einem kulinarischen Blickwinkel bis zu Spaghettis (roh und gekocht).
 Wenn die rohen Spaghetti weniger spröde wäre, hätten sie eine noch engere Ähnlichkeit mit linearen Alkanen. Quelle: Pixabay.
Wenn die rohen Spaghetti weniger spröde wäre, hätten sie eine noch engere Ähnlichkeit mit linearen Alkanen. Quelle: Pixabay. Die rohen Spaghetti repräsentieren den idealen und isolierten Zustand linearer Alkane, obwohl sie mit einer ausgeprägten Tendenz zum Brechen; Während der gekochten, unabhängig davon, ob sie sich ihrem natürlichen und synergistischen Zustand nähern oder nicht: Einige interagieren mit anderen in einem Ganzen (zum Beispiel das Pasta -Gericht).
Diese Arten von Kohlenwasserstoffen sind natürlich in Erdgas- und Ölvorkommen vorhanden. Die leichtesten haben Schmiereigenschaften, während sich schwere wie ein unerwünschter Asphalt verhalten; löslich in Paraffinen jedoch löslich. Sie dienen sehr gut als Lösungsmittel, Schmiermittel, Kraftstoffe und Asphalt.
[TOC]
Struktur der linearen Alkane
Gruppen
Es wurde erwähnt, dass die allgemeine Formel dieser Alkane C istNH2n+2. Diese Formel ist für alle Alkane gleich, ob linear oder verzweigt. Der Unterschied dann in der N- Das geht der Alcano -Formel voraus, deren Bezeichnung "normal" bedeutet.
Es wird später gesehen N- Es ist für Alkane mit einer Kohlenstoffzahl gleich oder weniger als vier nicht erforderlich (n ≤ 4).
Eine Linie oder Kette kann nicht aus einem einzigen Kohlenstoffatom bestehen, daher wird Methan zur Erklärung ausgeschlossen (CH4, n = 1). Wenn n = 2, haben wir das Ethan, Cho3-CH3. Beachten Sie, dass dieses Alkan aus zwei Methylgruppen besteht, Cho3, miteinander verbunden.
Erhöhen Sie die Anzahl der Kohlenstoffe, n = 3, das Alkanpropan wird erhalten, Cho3-CH2-CH3. Jetzt erscheint eine neue Gruppe, Cho2, Methylen genannt. Egal wie groß das lineare Alkane ist, Sie werden immer zwei Gruppen haben, nichts weiter: Cho3 und Ch2.
Kann Ihnen dienen: Iterbio: Struktur, Eigenschaften, Verwendungen, ErhaltenLängen ihrer Ketten
Wenn die Anzahl der Kohlenstoffe des linearen Alkans zunimmt, gibt es in allen resultierenden Strukturen eine Konstante: Die Anzahl der Methylengruppen ist erhöht. Nehmen Sie beispielsweise lineare Alkane mit n = 4, 5 und 6 an:
CH3-CH2-CH2-CH3 (N-Butan)
CH3-CH2-CH2-CH2-CH3 (N-Pentano)
CH3-CH2-CH2-CH2-CH2-CH3 (N-Hexan)
Die Ketten werden länger, weil sie zu ihren Strukturen gruppieren2. Somit unterscheidet sich ein umfangreiches oder kurzes lineares Alkan darin, wie viele Cho2 trennt die beiden Klemmengruppen CH3. Alle diese Alkane haben nichts plus zwei diese3: Zu Beginn der Kette und am Ende desselben. Wenn ich mehr hätte, würde dies das Vorhandensein von Auswirkungen bedeuten.
Ebenso kann das gesamte Abwesenheit von CH -Gruppen beobachtet werden, die nur in den Auswirkungen vorhanden sind oder wenn es Substituentengruppen gibt, die mit einem der Kohlenstoffe der Kette verbunden sind.
Die strukturelle Formel kann wie folgt zusammengefasst werden: CH3(CH2)N-2CH3. Versuchen Sie es zu bewerben und zu veranschaulichen.
Konformationen
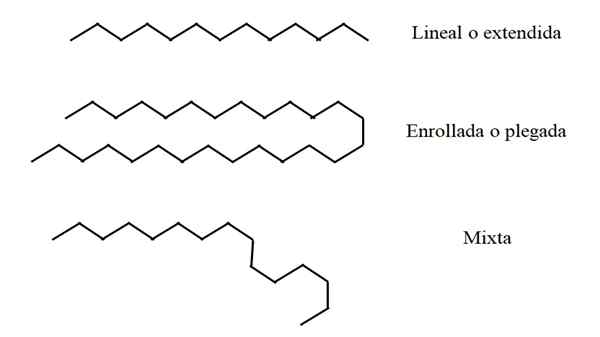 Strukturkonformationen linearer Alkane. Quelle: Gabriel Bolívar.
Strukturkonformationen linearer Alkane. Quelle: Gabriel Bolívar. Einige lineare Alkane können länger oder kürzer sein als andere. Somit kann n einen Wert von 2 bis ∞ haben; Das heißt2 und zwei CH -Gruppen3 Terminals (theoretisch ist möglich). Nicht alle Ketten "haben" im Weltraum genauso "auf die gleiche Weise".
Hier entstehen die strukturellen Konformationen von Alkanen. Was sie schulden? Zur Rotabilität der C-H-Verbindungen und der Flexibilität desselben. Wenn sich diese Links drehen oder verrotten.
Linear
Im oberen Bild ist beispielsweise eine Kette von dreizehn Kohlenstoffen, die linear oder erweitert bleibt. Diese Konformation ist ideal, da angenommen wird, dass die molekulare Umgebung die räumliche Disposition der Kettenatome minimiert. Nichts stört sie und muss nicht biegen müssen.
Es kann Ihnen dienen: Propylenglykol: Struktur, Eigenschaften, Synthese und VerwendungGerollt oder gefaltet
In der Mitte des Bildes erfährt die siebenundzwanzig Kohlenstoffkette eine externe Störung. Die Struktur, um "bequemer" zu sein, dreht ihre Links so, dass sie sich selbst faltet. Genau wie ein langer Spaghetti.
Computerstudien zeigten, dass die maximale Anzahl von Kohlenstoffen, die eine lineare Kette haben kann, n = 17 beträgt. Von n = 18 ist es ihm unmöglich, nicht zu falten oder gerollt zu werden.
Gemischt
Wenn die Kette sehr lang ist, kann es Regionen davon geben, die linear bleiben, während andere gebogen oder eingeschrieben wurden. Von allen ist dies vielleicht die Konformation, die der Realität am nächsten ist.
Eigenschaften
Physisch
Da sie Kohlenwasserstoffe sind, sind sie im apolaren Essenz und daher hydrophobisch. Dies bedeutet, dass sie nicht mit Wasser gemischt werden können. Sie sind wenig dicht, weil ihre Ketten zu viele leere Räume zwischen ihnen lassen.
Auch ihre physischen Zustände reichen von Soda (für n < 5), líquidos (para n < 13) o sólidos (para n ≥ 14), y dependen de la longitud de la cadena.
Interaktionen
Die Moleküle der linearen Alkane sind apolar, und daher sind ihre intermolekularen Kräfte vom Londoner Dispersionstyp. Die Ketten (wahrscheinlich eine gemischte Konformation annehmen) werden dann von der Wirkung ihrer Molekülmassen und der sofortigen induzierten Dipole ihrer Wasserstoff- und Kohlenstoffatome angezogen.
Aus diesem Grund, wenn die Kette länger wird und daher schwerer wird, steigt ihre Siedepunkte und ihre Fusion auf die gleiche Weise an.
Stabilität
Je länger die Kette ist, desto instabiler ist sie. Normalerweise leiden sie unterbrochen ihrer Verbindungen, um kleinere Ketten von einem großen zu verursachen. Tatsächlich ist dieser Prozess als bekannt als als Craqueo, Hoch verwendet bei der Ölraffinierung.
Nomenklatur
Um die linearen Alkane zu benennen, reicht es aus, den N-Indikator vor dem Namen hinzuzufügen. Wenn n = 3, wie es bei Propan der Fall ist, ist es für diesen Alkane unmöglich, einen Zweig darzustellen:
Kann Ihnen dienen: anorganische VerbindungenCH3-CH2-CH3
Das, was nicht aus n = 4 geschieht, das heißt, mit dem N-Blutane und den anderen Alkanen:
CH3-CH2-CH2-CH3
ENTWEDER
(CH3)2Ch-ch3
Die zweite Struktur entspricht dem Isobutan, das aus einem strukturellen Isomer des Butans besteht. Um einen voneinander zu unterscheiden, kommt Indicator N ins Spiel-. Und so kam es dass der N-Butano bezieht sich nur auf das lineare Isomer ohne Auswirkungen.
Je größer das N ist, desto größer ist die Anzahl der strukturellen Isomere und die größte Bedeutung muss N- verwenden, um sich auf das lineare Isomer zu beziehen.
Zum Beispiel die Oktan, c8H18 (C8H8 × 2 + 2), präsentiert bis zu dreizehn strukturelle Isomere, da viele Auswirkungen möglich sind. Das lineare Isomer wird jedoch benannt: N-Oktan, und seine Struktur ist:
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3
Beispiele
Sie werden unten erwähnt und um einige lineare Alkane zu beenden:
-Etano (c2H6): CH3CH3
-Propan (c3H8): CH3CH2CH3
-N-Heptano (c7H16): CH3(CH2)5CH3.
- N-Dekan (c10H22): CH3(CH2)8CH3.
-N-Hexadecano (c16H3. 4): CH3(CH2)14CH3.
-N-Nichtadecano (c19H40): CH3(CH2)17CH3.
-N-Eicosan (czwanzigH42): CH3(CH2)18CH3.
- N-Hektan (c100H202): CH3(CH2)98CH3.
Verweise
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. (5. Ausgabe). Editorial Addison-Wesley Interamerikaner.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10. Ausgabe.). Wiley Plus.
- Jonathan m. Guter Mann. (1997). Was ist das lange unverzweigte Alkan zur linearen globalen Mindestkonformation? J. Chem. Inf. Computer. Sci. 1997, 37, 5, 876-878.
- García Nissa. (2019). Was sind Alkane? Lernen. Erholt von: Studium.com
- Herr. Kevin a. Boudreaux. (2019). Alkane. Erholt von: Angelo.Edu
- Liste der Alkene mit geraden Ketten. [PDF]. Erholt von: Laney.Edu
- Helmestine, Anne Marie, ph.D. (7. September 2018). Nennen Sie die ersten 10 Alkane. Erholt von: thoughtco.com
- Schrullige Wissenschaft. (20. März 2013). Gerade Kettenalkane: Vorhersage von Eigenschaften. Erholt von: Quirkyscience.com
- Wikipedia. (2019). Höhere Alkane. Abgerufen von: in.Wikipedia.Org
- « Abgeleitet aus Kotangentberechnung, Demonstration, Übungen
- Cyclopentanoperhydofenantreno -Struktur und Bedeutung »

