Beta Galactosidase -Eigenschaften, Struktur, Funktionen
- 3773
- 0
- Ivan Pressler
Der Beta Galactosidase, Auch β-Galactosidase oder β-D-Galactohydrolyse bezeichnet.
Früher als "Lactase" bezeichnet, ist seine Verteilung sowie die der als Substrat dienen wirksamen Polysaccharide der Oligo- und β-Galaktosität extrem breit. Es kommt in Bakterien, Pilzen und Hefen; In Pflanzen ist es in Mandeln, Pfirsiche, Aprikosen und Äpfeln üblich und bei Tieren ist es in Organen wie Magen und Darm vorhanden.
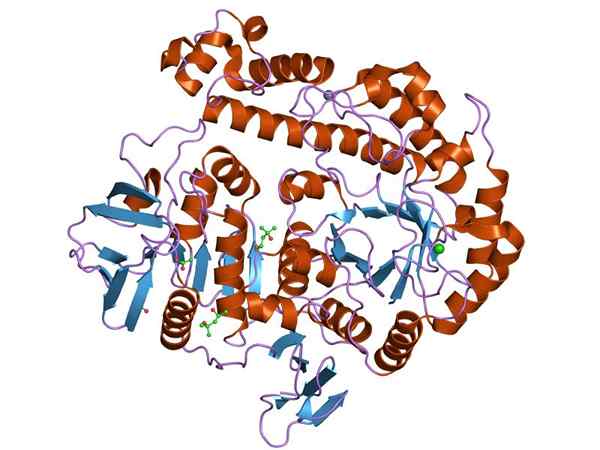
 Grafische Darstellung der Struktur des B-Galactosidase-Enzyms (Quelle: Jawahar Swaminathan und MSD-Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons)
Grafische Darstellung der Struktur des B-Galactosidase-Enzyms (Quelle: Jawahar Swaminathan und MSD-Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons) Das am meisten untersuchte Enzym ist das der Opeon Lac von UND. coli, Gen codiert Lacz, deren Studien der Schlüssel zum Verständnis der Funktionen genetischer Operats und vieler regulatorischer Aspekte von ihnen waren.
Es gehört derzeit zur am besten untersuchten Enzymgruppe und ihre bekannteste Funktion ist die Hydrolyse der glucosidischen Verbindungen von Laktose. Es erfüllt wesentliche Stoffwechselfunktionen in den Organismen, die es ausdrücken und auch mit unterschiedlichen industriellen Zwecken verwendet werden.
Unter den industriellen Anwendungen befinden sich die Entfernung von Laktose von Milchprodukten für laktoseunolerante Menschen und die Produktion mehrerer Galaktositätsverbindungen. Sie werden auch verwendet, um die Süße, den Geschmack und die Verdauung vieler Milchprodukte zu verbessern.
[TOC]
Eigenschaften
Zusätzlich zu Galaktositätsubstraten wie Lactose erfordern die meisten bekannten β-Galactosidasen divale Metallionen wie Magnesium und Natrium. Dies wurde durch die Entdeckung von Gewerkschaftsstandorten für diese Metalle in seiner Struktur bewiesen.
In der Natur vorhandene β-Galactosidas haben eine große Vielfalt von pH. Pilzenzyme funktionieren in sauren Umgebungen (2.5 bis 5.4), während Hefen und Bakterien zwischen 6 und 7 pH -Einheiten arbeiten.
Kann Ihnen dienen: gram negative Bakterienβ-Galactosidas-Bakterien
Bakterien haben große galato-hydrolytische Enzyme im Vergleich zu anderen analysierten Galaktosidas. In diesen Organismen katalysiert dieselbe Enzym drei Arten von enzymatischen Reaktionen:
- Hydrolyza Lactose zu seinen konstitutiven Monosacchariden: Galactose und Glukose.
- Katalysiert die Transgastilation von Lactose zu Alolactose, einem Disaccharidzucker, der an der positiven Regulation der Expression der zur Opeone gehörenden Gene beteiligt ist Lac, Eç.
- Hydrolysiert die Alolactose ähnlich wie es mit Laktose geht.
β-Galactosidas-Pilz
Pilze haben β-Galactosidase-Enzyme anfälliger für Galactose-Hemmung als Enzyme, die zu anderen Organismen gehören. Diese sind jedoch thermostabil und wirken in sauren pH -Bereichen.
Der durch diese Enzyme in Pilzen vermittelte Laktosestoffwechsel ist in extrazelluläres und zytosolisches Teilen unterteilt.
Struktur
Das β-Galactosidase-Enzym von Bakterien ist ein tetrameres Enzym (von vier identischen Untereinheiten A-D) und jedes seiner Monomere hat mehr als 1.000 Aminosäureabfälle, was ein Molekulargewicht von mehr als 100 kDa für jedes und mehr als 400 kDa für das komplexe Protein bedeutet.
Im Gegenteil in Pflanzen ist das Enzym erheblich kleiner und kann häufig als Dimer identischer Untereinheiten gefunden werden.
Die Domänen jedes Monomers werden mit den Zahlen von 1 bis 5 unterschieden. Die Domäne 3 hat eine Fassstruktur α/β „Tim“ und das aktive Zentrum am C-terminalen Ende des Laufs.
Kann Ihnen dienen: Tier- und Pflanzenorganisation und ihre EigenschaftenEs wird angenommen, dass die aktiven Stellen des enzymatischen Komplexes zwischen Monomeren geteilt werden.
Sein aktives Zentrum kann D-Glucosa und D-Galactose beitreten, den beiden Monosacchariden, aus denen sich Laktose zusammensetzt. Es ist besonders spezifisch für die D-Galactose, ist aber nicht so sehr für Glukose, so dass das Enzym auf andere Galaktoside wirken kann.
Funktionen
Bei Tieren
Im Darm des Menschen hängt die Hauptfunktion dieses Enzyms mit der Absorption von mit Nahrungsmitteln aufgenommenen Laktose aus, da es sich auf der Luminalfläche der Plasmamembran von Darmzellen in Form einer Bürstenform befindet.
Darüber hinaus wurde gezeigt, dass die lysosomalen Isoformen dieses Enzyms am Abbau vieler Glucolipide, Mucopolysaccharide und Galaktositätglykoproteine, die mehrere Zwecke auf verschiedenen zellulären Routen aufweist.
In Pflanzen
Pflanzen haben β-Galactosidase-Enzyme auf Blättern und Samen. Diese erfüllen wichtige Funktionen im Katabolismus der Galactolipide, die für Algen und Pflanzen im Allgemeinen charakteristisch sind.
In diesen Organismen beteiligt sich β-Galactosidase an den Prozessen des Pflanzenwachstums, der Reifung von Früchten und in den oberen Pflanzen das einzige bekannte Enzym.
In Industrie und Forschung
In der Lebensmittelindustrie im Zusammenhang mit Milchprodukten wird das β-Galactosidase-Enzym verwendet, um die Hydrolyse von Laktose in Milchprodukten zu katalysieren, die für viele der Defekte im Zusammenhang mit der Lagerung dieser Produkte verantwortlich sind.
Die Hydrolyse dieses Zucker.
Kann Ihnen dienen: Erdnahrungskette der Erde: Glieder und BeispieleDie β-Galactosidase, die industriell verwendet wird Aspergillus sp., Obwohl das von Hefe produzierte Enzym Kluyveromyces Lactis Es wird auch weit verbreitet.
Die β-Galactosidase-Aktivität, die zu wissenschaftlichen Begriffen wie „Laktosefermentation“ führt, wird routinemäßig auf die Identifizierung von Gram-negativen Enterobakterien getestet.
Darüber hinaus wird es medizinisch für die Herstellung von laktosfreier Milchprodukten und zur Formulierung von Tabletten verwendet, die von Laktos -Intoleranten verwendet werden, um Milch und deren Derivate zu verdauen (Joghurt, Käse, Eis, Butter, Cremes usw.),.
Es wird als "Biosensoren" oder "Biomarker" mit Vielfalt von Zwecken, von Immunoassays und toxikologischen Analyse bis hin zur Analyse der Genexpression und Diagnose von Pathologien dank der chemischen Immobilisierung dieses Enzyms in besonderen Unterstützung in besonderen Unterstützung verwendet.
Verweise
- Henrissat, geb., & Daviest, G. (1997). Strukturelle und sequenzbasierte Klassifizierung von Glycosidhydrolas. Aktuelle Biologie, 7, 637-644.
- Huber, r. (2001). Beta (B) -Galactosidase. Akademische Presse, 212-214.
- Husain, q. (2010). β Galactosidaese und ihre potenziellen Anwendungen: eine Überprüfung. Kritische Überprüfungen in der Biotechnologie, 30, 41-62.
- Richter, d. H., Matthews, geb. W., & Huber, r. UND. (2012). LacZ B-Galactosidase: Struktur und Funktion eines Enzyms von historischer und molekularer biologischer Bedeutung. Wissenschaftsprotein, einundzwanzig, 1792-1807.
- Lee, b. UND., Han, j. ZU., IM, J. S., Morrone, a., Johung, k., Goodwin, c.,… Hwang und. S. (2006). Seneszenz -asoziierte β -Galactosidase ist lysosomale β -Gastosidase. Alternde Zelle, 5, 187-195.
- Matthews, geb. W. (2005). Die Struktur von e. β-Galactosidase coli. C. R. Biologien, 328, 549-556.
- McCarter, j. D., & Withers, s. G. (1994). Mechanismen der enzymatischen Glykosidhydrolyse. Aktuelle Meinung in der Strukturbiologie, 4, 885-892.
- Richmond, m., Grau, j., & Stine, c. (1981). Beta-Galactosidase: Überprüfung von neuem Anch im Zusammenhang mit technologischer Anwendung, Ernährungsbedenken und Immobilisierung. J Dairy Sci, 64, 1759-1771.
- Wallenfels, k., & Weil, r. (1972). B-Galactosidase.

