Eisenhydroxid (ii) Struktur, Eigenschaften, verwendet, verwendet
- 1443
- 339
- Nick Laurén
Er Eisenhydroxid (II), Auch Eisenshydroxid genannt, ist es eine anorganische Verbindung der chemischen Formel (OH)2. Wenn seine Reinheit hoch ist, besteht sein Feststoff nur aus Glaubenionen2+ und oh- In einer 2: 1 -Beziehung; Wassermoleküle und verschiedene ionische Spezies können jedoch enthalten, wodurch die Position verändert wird.
Repräsentiert die "reduzierte" Form des berühmten Rost, die aus Glaubenionen besteht, rötliche Oberfläche3+; Während des Greenish Rust überwiegt der Glaube vorherzusagen2+, neben oh- und eine andere Anzahl von Anionen: co32-, SW42-, NEIN3- und Haluros (f-, Cl-,… ), Zum Beispiel. Das Ergebnis, obwohl die Basis dieses grünen Rostes Glaube ist (OH)2, ist, dass verschiedene Feststoffe erhalten werden.
 Grünoxid auf Eisenoberfläche: Quellmaterial dieser Art von Hydroxid. Quelle: Pixabay.
Grünoxid auf Eisenoberfläche: Quellmaterial dieser Art von Hydroxid. Quelle: Pixabay. Im täglichen Leben kann dieses Hydroxid an gemeinsamen Orten in Betracht gezogen werden. Zum Beispiel hat das obere Bildschiff seine überdachte Oberfläche von grünem Rost (nicht Patina). Da ist der Glaube (OH)2, jedoch begleitet von zahlreichen Ionen aus den Wellen des Meeres.
Chemisch gesehen hängen die Eigenschaften und Verwendungen dieses Materials vom Glaubenskation ab2+ und von seiner Tendenz, sich in den Glauben zu verwandeln3+. Es ist ein Reduktionsmittel, das unter grundlegenden Bedingungen schnell mit Sauerstoff reagiert. Daher sollte es in inerten Atmosphären und sauren Lösungen verwendet werden.
[TOC]
Eisenhydroxidstruktur (II)
Links
Nur Glauben betrachten (OH)2 Rein, es gibt nichts mehr Glaubenionen2+ und oh-.
Die Wechselwirkungen zwischen ihnen müssen theoretisch von ionischer Natur sein; Jeder Glaube2+ zieht zwei Anionen an, oh-, deren nicht leitende Attraktionen eine strukturelle und sich wiederholende Ordnung festlegen, die einen Kristall definiert; Das wiederum führt zu grünem Roststaub.
Es kann Ihnen dienen: Zinkhydroxid (Zn (OH) 2)Das Problem ist, dass es zwischen beiden Ionen einen bestimmten kovalenten Charakter gibt, und daher kann eine ionische Fe-OH. In Anbetracht eines teilweise ionischen Fe-OH.
Doppelschichten Hydroxid
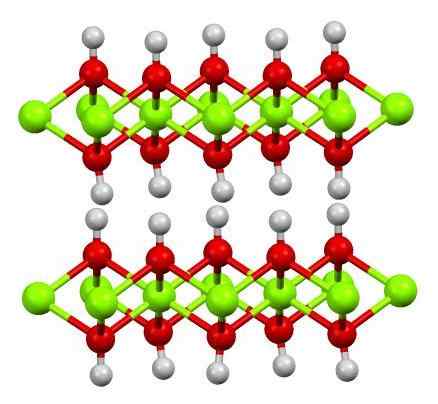
 Glaubensstruktur (OH) 2. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Glaubensstruktur (OH) 2. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Die Struktur von reinem Eisenhydroxid mit einem Modell von Kugeln und Balken ist oben gezeigt. Fe -Kationen2+ Sie werden von den Chillón Green Kughes vertreten, während OH -Anionen- Für die roten und weißen Kugeln. Beachten Sie, wie Glaubenionen ausgerichtet sind2+ Dank der Wechselwirkungen (ionischkovalent) mit dem OH-.
Warum sind diese Struktur doppelte Hydroxideschichten? Das Bild selbst bietet die Antwort: Es gibt zwei Reihen oder Schichten von OH- Für jeden Glauben2+; Das heißt, der Anteil 2: 1 des Glaubens (OH) wird beibehalten2 zu Beginn erwähnt.
Struktureinheiten für Glauben (OH)2 Sie sind dann diese Sandwiches, in denen die Schichten von OH- Sie würden kommen, um die Brote zu repräsentieren; negativ belastetes Brot und das daher keinen auffälligen braunen Kristall repariert.
Andererseits richten sich die Atome von H auch aus und vertuschen miteinander. Wenn diese Hydrogene an das Konzept der Polarität und der Elektronegativität erinnert werden, weisen sie eine leicht positive partielle Belastung δ+auf; Was, obwohl schwach, einen positiven Bereich haben kann, in dem andere Anionen oder Moleküle untergebracht sind.
Hydrate
Wenn Glaube (OH)2 Es löst sich im Wasser, seine Moleküle koordinieren mit dem Metallzentrum des Glaubens2+ Um eine komplexe ACU zu bilden: [Glaube (h)2ENTWEDER)4(OH)2]. Dieser Komplex hat eine oktaedrische Geometrie für sechs Liganden: vier Wassermoleküle und zwei OH-. In Eisenhydroxid ist das Panorama jedoch etwas anders.
Kann Ihnen dienen: Gesetz über die Erhaltung der MaterieIn Hydrat hypothetische Formel Fe (OH)2· NH2Oder Wassermoleküle sind genau zwischen den beiden Hydroxidschichten untergebracht; Das heißt, sie interagieren durch Dipol-Ionen-Kräfte mit weißen Hydrogenen oder Kugeln. Es ist, als ob zwei Ohfeoh -Spiele gepackt wären und Wasser durchsetzt wurde, um sie zu gruppieren: ohfeoh (h2O) Ohfeah.
Wassermoleküle sind sehr dynamisch und verhindern, dass Hydratpartikel beträchtliche Größen erwerben und folglich ein festes kolloidales oder Gelee bilden.
Grünes und rotes Rost
In Hydraten haben die Hydroxidschichten eingestrichene Wassermoleküle; Sie können jedoch andere Anionen haben (bereits erwähnt), was eine Vielzahl von grünen Herblen verursacht. Sie können auch Moleküle "fangen", die so groß wie DNA oder Medikamente sind.
Glaubenionen können nicht nur präsent sein2+, aber auch Glaube3+, Produkt der inneren Oxidation, die durch einen durchsagten Sauerstoff verursacht wird. Es ist sichtbar zu beobachten, dass grünes Rost (U -Oxid) rötlich wird, wenn die Konzentration des Glaubens zunimmt3+.
Eigenschaften
 Testrohr mit Eisenhydroxid im Wasser. Quelle: Chemicalinterust [Public Domain]
Testrohr mit Eisenhydroxid im Wasser. Quelle: Chemicalinterust [Public Domain] Glaube (OH) ist oben gezeigt2 Niederschlag in einem Reagenzglas. In reichlich Wasser muss die komplexe ACU über der neu genannten Struktur vorherrschen. Beachten Sie, dass die Oberfläche aufgrund der Oxidation des Glaubens wie eine orangefarbene Farbe aussieht2+ zum Glauben3+ für den Sauerstoff der Luft; Das heißt, dieses Hydroxid ist ein Reduktionsmittel:
Glaube2+ Glaube3+ + Und-
Das physikalische Erscheinungsbild dieser Verbindung in ihrem reinsten Zustand ist das eines braunen Feststoffs:
 Reines Eisenhydroxid. Quelle: Ondřej Manggl [Public Domain]
Reines Eisenhydroxid. Quelle: Ondřej Manggl [Public Domain] Was je nach Feuchtigkeitsniveau als Jelly -Green -Feststoff dargestellt werden kann. Es ist ziemlich unlöslich in Wasser (ksp= 8 · 10-16 und Löslichkeit = 0,72 g/100 ml bei 25ºC) und eine Molmasse von 89,86 g/mol und eine Dichte von 3,4 g/ml aufweist.
Es kann Ihnen dienen: die 20 Arten der Chemie und deren VerweigerungEs werden kein Siede- oder Fusionspunkt für diese Verbindung gemeldet; Wahrscheinlich aufgrund der Tatsache, dass es vor einer Wärmequelle dehydriert wird und sich in Eisenoxid umgewandelt, hässlich:
Glaube (OH)2 => Hässlich + h2ENTWEDER
Anwendungen
Organische qualitative Analyse
Seine Reduktionsleistung wird verwendet, um das Vorhandensein von Nitroverbindungen, RNO, zu bestimmen2. Die Reaktion, für die ein positiver Test erhalten wird, wird mit der folgenden chemischen Gleichung dargestellt:
Rno2 + 6FE (OH)2 + 4H2O => rnh2 + 6FE (OH)3
Der Glaube (OH)3 Niederschläge als brauner redizo -Fest2.
Seleniumoxoanions Reduzierer
Die reduzierende Kraft des Glaubens (OH)2 Es wurde auch verwendet, um SEO -Anionen zu reduzieren32- (Selenito) und SEO42- (Selenat) zu elementarem Selen,,. Praktisch ermöglicht es die Entfernung solcher schädlichen Antriebsgraden in Form eines unlöslichen und leicht abnehmbaren Seleniums solide.
Doppelschichten Materialien
Seine reine Struktur und grüner Rost ist eine Quelle der Inspiration für das Design neuer Materialien mineralogischer Eigenschaften.
Es wird geschätzt, dass die Funktion dieser Funktionen den Transport einer bestimmten Spezies zwischen ihren Schichten ermöglicht, so dass ihre Befreiung kontrolliert oder auf das aktive Zentrum reduziert werden kann (Böden, Zellen, Metalloberfläche usw.).
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Eisen (ii) Hydroxid. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2019). Eisenhydroxid. Pubchem -Datenbank. CID = 10129897. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Nick Doe. (S.F.). Tests auf Phenole und Nitrogruppen. Chemie 211. Abgerufen von: Akademikern.Wellesley.Edu
- Clark Jim. (27. April 2019). Chemie von Eisen. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Technische Software von Kingston. (2019). Rostchemie. Korrosionsärzte. Erholt von: Korrosionsdotoren.Org
- Zingaro, Ralph a. et al. (1997). Reduktion von Oxoseleniumanionen durch Eisen (II) Hydroxid. Umwelt International. 23 (3): 299-304. Doi: 10.1016/S0160-4120 (97) 00032-9
- « Chloroxid (v) Eigenschaften, Struktur, verwendet
- Chloroxid (III) Eigenschaften, Struktur, verwendet »

