Chloroxid (v) Eigenschaften, Struktur, verwendet

- 2824
- 784
- Ivan Pressler
Er Chloroxid (V) Es ist eine sehr instabile anorganische Verbindung, deren chemische Formel CL ist2ENTWEDER5. Es ist eines der vielen Chloroxide, die durch molekulare oder sogar radikale Spezies gekennzeichnet sind.
Das Cl2ENTWEDER5 Er hat nur Leben auf Papier und theoretischen Berechnungen gefunden; Seine Existenz wurde jedoch nicht ausgeschlossen und es ist wahrscheinlich, dass einige charakterisiert werden können (durch fortgeschrittene Spektroskopie -Techniken)). Was aufgrund allgemeiner Chemiekonzepte für dieses Oxid vorhergesagt werden können, ist, dass es das Anhydrid der Chlorsäure ist, HCLO3.
 CL2O5 -Molekül. Quelle: Jynto [CC0].
CL2O5 -Molekül. Quelle: Jynto [CC0]. Das hypothetische Chloroxidmolekül (V) ist oben gezeigt (V). Beachten Sie, dass das Vorhandensein des CL, weil es sich um ein Molekül handelt+5; Noch weniger, wenn er eine solche polarisierende Kraft haben muss, um Sauerstoff zu erzwingen, und kovalent miteinander verbindet.
Wie jede instabile Verbindung setzt es Energie frei, um stabilere Produkte zu zersetzen. verarbeiten, dass in vielen Fällen explosiv ist. Wenn der Cl2ENTWEDER5 Es bricht die Freiheit zusammen2 ICH2. Es wird theoretisiert, dass im Wasser abhängig vom Isomer von CL2ENTWEDER5, Es können mehrere Chloroxoäakids gebildet werden.
[TOC]
Eigenschaften
Die Molmasse des CL2ENTWEDER5 ist 150.9030 g/mol. Aus dieser Masse und ihrem hypothetischen Molekül kann es vermutet werden, dass es wahrscheinlich eine ölige Flüssigkeit wäre, wenn es isoliert werden kann; Natürlich mit dem physischen Erscheinungsbild des CL vergleichen2ENTWEDER7.
Obwohl es nicht isoliert oder charakterisiert werden kann, ist dieses Chloroxid sauer, kovalent und muss auch ein kleines Dipolmoment aufweisen. Seine Säure ist verständlich, wenn die chemische Gleichung ihrer Hydrolyse analysiert wird:
Kann Ihnen dienen: Amagatgesetz: Erklärung, Beispiele, ÜbungenCl2ENTWEDER5 + H2Oder 2HCLO3
Der HCLO sein3 Die Chlorsäure. Die umgekehrte Reaktion würde dazu führen, dass die Säure dehydriert werden kann:
2HCLO3 => Cl2ENTWEDER5 + H2ENTWEDER
Andererseits, wenn der CL2ENTWEDER5 Sobald es auftritt, zersetzt es sich:
2cl2ENTWEDER5 => 4CLO2 + ENTWEDER2
Es ist daher eine Vermittlerspezies anstelle eines Oxids richtig gesehen. Seine Zerlegung muss so schnell sein (angesichts der Tatsache, dass der CL sogar gebildet wird2ENTWEDER5), die nicht durch aktuelle instrumentelle Analysetechniken erkannt werden konnten.
Chloroxidstruktur (V)
Molekül
Im oberen Bild wurde die Struktur des hypothetischen CL -Moleküls gezeigt2ENTWEDER5 Mit einem Kugeln und Bars Modell. Rote Kugeln repräsentieren Sauerstoffatome und grün bis Chlor. Jedes Chlor hat eine trigonale Pyramidenumgebung, daher muss seine Hybridisierung SP sein3.
Somit das CL -Molekül2ENTWEDER5 Es kann als zwei trigonale Pyramiden angesehen werden, die durch einen Sauerstoff verbunden sind. Aber wenn es sorgfältig beobachtet wird, führt ein Pyramiden seine Sauerstoffatome und die andere aus der Ebene (in Richtung des Lesers) heraus.
Von hier aus wird vermutet, dass es Rotationen im Link gibt oder2Cl-o-Cl2, das Molekül relativ dynamisch machen. Beachten Sie, dass die Formel oder2Cloclo2 Es ist eine Möglichkeit, die Struktur des CL darzustellen2ENTWEDER5.
Lewis -Struktur
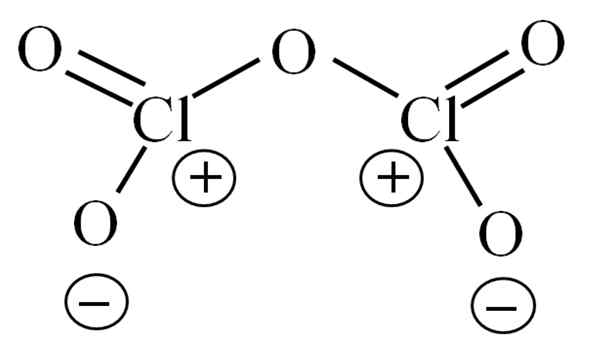 Lewis -Struktur für den hypothetischen CL2O5. Quelle: Gabriel Bolívar.
Lewis -Struktur für den hypothetischen CL2O5. Quelle: Gabriel Bolívar. Bisher hat das Molekül selbst nicht zugelassen, was seine Instabilität fällig ist. Um diese Frage zu beleuchten, wird die oben dargestellte Lewis -Struktur verwendet, die oben dargestellt wird. Beachten Sie, dass die Struktur fälschlicherweise flach ist, aber im vorderen Unterabschnitt wurde klargestellt, dass sie nicht so ist.
Kann Ihnen dienen: Natrium Azid (NAN3): Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenWarum beide Chloratome positive formale Lasten haben? Weil Chlor ein Paar frei von Elektronen hat, die überprüft werden können, wenn die Valencia -Link -Theorie angewendet wird (was aufgrund der Vereinfachung hier nicht durchgeführt wird). Somit ist seine formale Last:
CF = 7 - (4 + 2) = 1
Und was hat das mit Ihrer Instabilität zu tun?? Nun, Chlor ist erheblich elektronegativ und daher ein schlechter Träger positiver formeller Lasten. Dies kehrt zum CL zurück2ENTWEDER5 Eine äußerst saure Spezies, da sie Elektronen gewinnen muss, um den elektronischen Bedarf der beiden Chloros zu liefern.
Das Gegenteil geschieht mit dem BR2ENTWEDER5 und das i2ENTWEDER5, Oxide, die unter normalen Bedingungen existieren. Dies liegt daran, dass sowohl Brom als auch Jod weniger elektronegativ sind als Chlor; Und deshalb unterstützen sie die positive formelle Last besser.
Isomere und ihre jeweilige Hydrolyse
Bisher ist die gesamte Erklärung einem der beiden Isomere des CL gefallen2ENTWEDER5: Das Ö2Cloclo2. Welches ist der andere? Das Ö3Cloclo. In diesem Isomer fehlen den Chloros positive formale Lasten und sollten daher ein stabileres Molekül sein. Beide jedoch sowohl die oder2Cloclo2 wie das o3Cloclo sollte hydrolysereaktionen leiden:
ENTWEDER2Cl-o-Cl2 + H2O => 22Cl-oh (das ist nichts weiter als der HCLO3)
ENTWEDER3Cl-o-clo + H2O => o3Cl-oh (HcLO4) + HO-clo (HCLO2)
Beachten Sie, dass bis zu drei Chloroxoäakids gebildet werden können: HCLO3, HCLO4 Und HCLO2
Nomenklatur
Sein Name 'Chloroxid (v)' entspricht der gemäß der Aktiennomenklatur zugewiesenen. Das Cl2ENTWEDER5 Es kann auch zwei weitere Namen haben: Dicloro und Cleoringanhydrid -Pentaoxid, die durch systematische bzw. traditionelle Nomenklaturen zugeordnet sind.
Kann Ihnen dienen: Titan: Geschichte, Struktur, Eigenschaften, Reaktionen, verwendetAnwendungen
Mehr als Computerstudien zu motivieren, der CL2ENTWEDER5 Es fehlt der Gebrauch, bis es entdeckt, isoliert, charakterisiert, gespeichert ist und hat gezeigt, dass es nicht zum geringsten Kontakt explodiert.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Sandra Luján Quiroga und Luis José Perissinotti. (2011). Chloroxoäuren und Struktur von Dichloroxiden. Chem. Pädagoge, Vol. 16.
- Chemische Formulierung. (2019). Chloroxid (V). Wiederhergestellt von: Quimica -Formulierung.com
- Linus Pauling. (1988). Allgemeine Chemie. Dover Publications, Inc., New York.
- Richard c. Ropp. (2013). Enzyklopädie der alkalischen Erdverbindungen. Elsevier.
- « Hintergrund und Eigenschaften von Neolamarckismus
- Eisenhydroxid (ii) Struktur, Eigenschaften, verwendet, verwendet »

